Když pomineme otázku, zda se bude i nadále bude oteplovat, což není například vzhledem k možnému kolapsu severoatlantické termohalinní cirkulace (THC, známější jako Golfský proud) tak úplně jisté a mlčky přejdeme možnosti, že přifoukávání oxidu uhličitého do atmosféry a jiné lidské snažení nemusí v pozorovaném oteplováním hrát tu nejdůležitější roli, stále nám ještě zůstane jako nepopiratelný fakt momentálně zvýšený obsah oxidu uhličitého v atmosféře.
Ten podle dosavadních zjištění začal stoupat někdy počátkem průmyslové revoluce v 19. století a teď činí přibližně 380 ppm (částic z milionu). Pokud nás to znepokojuje, bylo by dobré s tím něco provést.
Jak na to? Možných cest je víc, přitažlivé i odpudivé. Mezi projekty, co příliš neznásilňují svobodný trh, lze zahrnout i odčerpávání hlavního skleníkového plynu z atmosféry pomocí rostlin. Oxid uhličitý totiž, krom toho, že je skleníkovým plynem, funguje i jako substrát pro fotosyntézu. Rostliny z něj za pomoci slunečního záření a vody dokáží udělat cukry a kyslík a tak ho z atmosféry spotřebovávají. Kupodivu to ale zatím nefunguje.
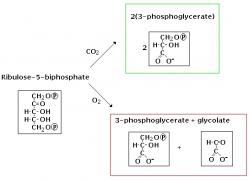
Proč? Důvod je velice prostý. Enzym RuBisCO (čili hezky česky ribulózo-1,5-bisfosfát karboxyláza/oxygenáza), který ve fotosyntetických reakcích zelených rostlin hraje klíčovou roli, je šmejd. Je vlastně pozoruhodný v mnoha ohledech. Pochází z bakterií, protože dnešní plastidy jsou vlastně dávné fotosyntetické bakterie, čili sinice, které vlezly do eukaryotního předka rostlin a vytvořili s ním koalici – dnešní rostlinou buňku. Vytvářejí ho dvě podjednotky, velká a malá, přičemž velkou (rbcL) kóduje chloroplastová DNA a ta malá (přibližně 2,5 krát menší rbcS) se během evoluce přesunula do eukaryotního jádra. Zároveň je to patrně nejhojnější protein na planetě. Nepochybně i díky tomu, že je v tom, co dělá úplně nemožný. Během fotosyntézy má karboxylovat ribulózo-1,5-bisfosfát, čili navázat vzdušný oxid uhličitý a poslat ho dalším enzymům, které z něj postupně udělají cukr. Ve skutečnosti je tak špatný, že v jedné pětině všech katalyzovaných reakcí místo karboxylace oxiduje a pracně získaný uhlík tak zase zbytečně vypouští zpátky do vzduchu. Je tak neuvěřitelně pomalý, že zatímco normální enzymy zvládnou tisíce reakcí za vteřinu, RuBisCO jich stihne jen několik. Proto ho rostliny musí mít v buňkách tolik.

Za normálních podmínek a když je dostatek světla limituje rychlost fotosyntézy právě neštastné RuBisCO. Všechny ostatní enzymy zúčastněné na fotosyntéze na něj znuděně čekají. Háček by mohl být v tom, že fixace oxidu uhličitého je tak náročná a že líp to prostě nejde. Tomu by nasvědčovalo i to, že se vědci už hodně dlouho snažili vyrobit šikovnější RuBisCO a zatím neúspěšně. Zdálo se, že každý lidských zásah do RuBisCO je jenom k horšímu.
Nejnovější práce týmu badatelů pod vedením proteinového inženýra Ichira Matsumury z americké Emory University School of Medicine v Atlantě ukázala, že to může být úplně jinak. Matsumura dělá ve své laboratoři šílené věci, které jistě nepotěší žádného kreacionistu. Studuje mechanismy molekulární evoluce a soustředí se na to, jak vznikají prospěšné mutace. Narozdíl od většiny molekulárních mágů jenom nekouká na existující potvůrky a neporovnává jejich sekvence. On si molekulární evoluci sám experimentálně spouští v laboratoři.
Nejdřív si namutuje gen pro protein, který ho zajímá, aby vytvořil variabilitu. Stejně jako to dělá spontánní přírodní výběr sám od sebe. Potom naslepo nastrká zmutované verze genu do bakterie E. coli. Nechá je v bakteriích mutovat dál, pak se podívá, zhodnotí jejich funkčnost, vyhodnotí ty zajímavé a pak je zase mutuje. Přesně jako přírodní výběr. Rozdíl je v tom, že přírodní výběr je opatrnější a „dívá“ se na nově vzniklé mutace skrze celkovou úspěšnost při množení, kdežto Matsumura si množí ty kopie genu, které ho zaujaly nějakou konkrétní funkcí, což občas může být s celkovou úspěšností v rozporu.
Matsumura to zkusil i s RuBisCO. Použil geny pro velkou i malou podjednotku RuBisCO od sinice rodu Synechococcus. Mutované verze genu vložil do populace bakterií E. coli, společně s dalším pomocným enzymem fosforibulózokinázou (prkA), Díky tomu mohla E. coli získávat energii přes oxid uhličitý, což normálně neumí. Nakonec vznikla řada úspěšných mutantů, přičemž ty nejrychlejší se dokázaly exprimovat až 500-krát rychleji, než původní RuBisCO. Zároveň byly zhruba 5-krát účinnější při vázání oxidu uhličitého.
Autoři jsou velmi zdrženliví, výsledky komentují opatrně a připouštějí, že chování proteinů mohlo být eventuelně ovlivněno podmínkami experimentu. Nicméně, je ironií, že pokud byli úspěšní, vyvinuli enzym lepší než ten přírodní a to nikoliv inteligentním projektem, ale slepým působením evolučních sil. Až zpětně zjišťovali, k jakým změnám tam vlastně došlo. Pokud překonáme dětinský strach z genetických modifikací a když výzkum v tomhle směru nenarazí na zásadní obtíže, je možná úklid nadbytečného oxidu uhličitého jen otázkou času a peněz.
Pramen: Protein Engineering, Design & Selection (vyjde v únoru)
Diskuze: