Vědci z Lawrence Berkeley National Laboratory (Berkeley Lab), U.S. Department of Energy (DOE), objevili proteiny plnící úlohy jak v imunitním systému, tak v systému buňky zbavující ji nefunkčních anebo škodlivých částí. Tyto bílkoviny ukazují na „komunikaci“ mezi těmito dvěma systémy při reakci na narušení organismu patogeny.
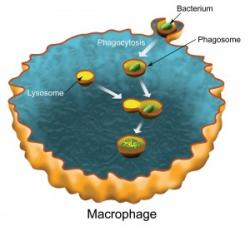
Výsledkem spolupráce výzkumných skupin Carolyn Bertozzi, ředitelky centra pro nanovědu Molecular Foundry v Berkeley Lab, a Jay Keaslinga, ředitele Physical Bioscience Division v Berkeley Lab, bylo získání profilů 546 různých typů bílkovin v membráně fagozómu, což je organela makrofágů - buněk, které „požírají“ a likvidují narušitelské organismy procesem nazvaném fagocytóza. To představuje dosud nejobsažnější a nejpodrobnější proteomickou analýzu fagozomální membrány.
„Byli jsme schopni identifikovat mnoho nových proteinů, o kterých ani nebylo dříve známo, že se vyskytují ve fagozómu,“ řekla Wenqing Shui, členka obou výzkumných skupin a specialistka na proteomiku, která byla hlavní autorkou dokumentu zveřejněném v Proceedings of the National Academy of Sciences (PNAS). Dokument publikovaný v PNAS je nazván: “Membrane proteomics of phagosomes suggests a connection to autophagy.” Na této studii se krom Shui, Bertozzi a Keaslinga podíleli také Leslie Sheu, Jun Liuc, Brian Smart, Christopher Petzold, Tsung-yen Hsieh a Austin Pitcher. Bertozzi a Keasling jsou také profesory na University of California v Berkeley. Krom toho Bertozzi provádí výzkumy na Howard Hughes Medical Institute a Keasling je ředitelem Joint BioEnergy Institute.
„Jeden z nových proteinů nalezený výlučně v naší studii, LC3-II, je považován za marker autofágie, což je proces, který umožňuje buňkám zbavovat vlastní cytoplazmu škodlivin,“ řekla Shui. „Nejenom, že byl LC3-II přítomen ve fagozómu, ale byla prokázána i jeho souvislost se „samoúklidem“ buňky, když jeho hladina byla zvýšena při indukci autofágie v makrofágu a klesala, když autofágie byla potlačena. To naznačuje na jakousi komunikaci mezi autofágií a fagocytózou, která může hrát důležitou úlohu v reakci imunitního systému.
Když bakterie nebo jiná cizorodá částice pronikne do organismu, tak první obrannou linií jsou makrofágy, které pohlcují a zadržují vetřelce v membránových váčcích svých fagozómů. Když už jsou tito vetřelci úspěšně zadrženi, tak mohou být zlikvidováni enzymy z další buněčné organely, lysozómu, který se spojí s fagozómem. Makrofágy, stejně jako další buňky, využívají lysozomální enzymy k údržbě svého vnitřního prostředí. Nicméně, až dosud neexistoval žádný přímý biochemický důkaz spojení mezi fagocytózou a autofágií.

Při práci s preparáty obsahujícími fagozómy izolované z myších buněk, předvedla Shui a její kolegové podrobnou analýzu proteinového obsahu fagozomální membrány. Na rozdíl od dřívějších proteomických studií, které zkoumaly úplnou organelu a zaměřovaly se na hojné druhy hydrofilních bílkovin, tak studie skupin Bertozziové a Keaslinga byla specializována na membránu a zahrnovala i hydrofobní proteiny, které jsou přítomné v membráně v relativně malém množství.
„Byli jsme schopní předvést endogenní úroveň LC3-II ve fagozómech makrofágu prostřednictvím kombinace citlivých proteomických technik a biochemických zkoušek,“ řekla Shui. „Toto je vynikající ukázka toho, jak nezávislá a přesná proteomická studie může osvětlit odlišné funkce a dráhy, které může organela provádět.“
Protein LC3-II je klíčovou součástí autofágního procesu a objev, že úroveň jeho přítomnosti ve fagozómech je upravována aktivitou autofágního procesu (spolu s jinými nově identifikovanými fagozomálními proteiny, které nebyly dříve spojovány s autofágií), poukazují na to, že autofágie hraje dosud neznámou roli v imunitní reakci, zejména proti vnitrobuněčným patogenům, jakým je například Mycobacterium tuberculosis.
Shui vysvětlovala: „Poté, co jsou mycobacteria fagocytována makrofágní buňkou, jsou schopna zničit rozmanité obranné mechanismy hostitele, včetně schopnosti zabíjení bakterií ve fagozómech, a přežít uvnitř buňky. To vypadá, že indukovaná autofágní aktivita podporuje zabíjení mycobacterií ve fagozómech (to byl závěr studie Vojo Deretic a jeho výzkumného týmu na University of New Mexico), a my se domníváme, že mycobacteria mohou produkovat specifické látky, které působí proti baktericidním účinkům autofágní aktivace.“
Výzkumné skupiny Bertozziové a Keaslinga nyní testují, zda některé sloučeniny produkované mykobakterii mohou upravovat autofágní aktivitu makrofágů, Také pátrají po proteinech, které by mohly specificky zprostředkovávat autofágii, stejně jako dozrávací proces fagozómů.
Shui řekla: „Mohli bychom být schopní otevřít nové cesty k farmakologickým zásahům, které budou fungovat stejně dobře při tuberkulóze i dalších infekčních onemocněních.“