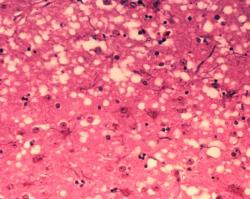
Ne nadarmo se prionovým chorobám říká transmisivní spongiformní encefalopatie. Vysloužily si to díky své infekčnosti a nálezech na mozku, který na řezu vykazuje charakteristickou strukturu mořské houby s mnoha vakuolami. Prionové nemoci postihují jak zvířata (BSE skotu, klusavka u ovcí, chronický únavový syndrom jelenovitých,…), tak člověka (Creutzfeldt-Jakobova choroba, kuru,...). Patologický nález je vždy stejný - mozková tkáň se rozpadá a dělají se v ní díry, které někomu připomínají houbu, jinému ementál. Na vině je prionový protein, který se někdy nevhodně poskládá a vznikne prion. Tento kousek bílkoviny pak „přesvěčuje“ ke změně tvaru všechny prionové molekuly, jichž se jen dotkne. Tak se z původního „semínka“ začnou šmodrchat další a další molekuly. Za normálního stavu je prionový protein běžnou součástí buněčných membrán a v případě jejich opotřebení se jich buňka umí zbavit. S nevhodně poskládanou molekulou ale zatočit neumí a tak jej skladuje, bobtná, až nakonec přecpáním praskne a priony se vydají vstříc dalším mozkovým buňkám. Infekci nezastaví antibiotika ani antivirotika, protože původcem není ani bakterie ani virus. Infekční částicí je pouhá molekula proteinu, která je prakticky nezničitelná a podle toho vypadá prognóza – diagnóza znamená jistou smrt.
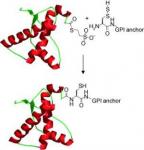
Normální a GM myši - dva nepatrně odlišné typy prionů
U nenakažených jedinců je normální prionový protein (PrP) zakotven v membráně buňky pomocí lipido-fosfáto-cukerné molekulární kotvy (glykosylfosfatidylinositol). Pokud se normální zdravá myš infikuje ovčím prionem, onemocní a pojde.
Myši, které vědci geneticky pozměnili tak, že jejich prionovému proteinu kotva chybí, také onemocní, pokud se setkají s ovčím prionem. I když je původce onemocnění v obou případech shodný, u myší „bez kotvy“ se nemoc klasické prionové chorobě vůbec nepodobá, ale překvapivě má znaky lidské Alzheimerovy choroby.
Z toho plyne, že prionových chorob bude bezpochyby více, než jsme si představovali a také že jejich projevy mohou být různorodější. Pro prionové choroby přestal být „spongiózní mozek“ jejich společným znakem. Pokud charakteristický znak, podle něhož dostaly jméno, přestal platit, máme tu problém - podle čeho je teď členit? Vědci navrhují aby dělícím znakem byla přítomnost nebo absence „kotvy“.
Hrátky s kotvou
Normální prionové proteiny využívají specifické molekuly glykofosfoinositolu (GPI) k uchycení v membráně hostitelské buňky, takzvanou již zmíněnou kotvu. Její úloha se ukázala, když jí vědci genetickou modifikací z prionového proteinu odstranili. Priony u myší bez této kotvy se k mozkovým buňkám nepoutaly, ale volně se potulovaly tělními tekutinami. Kotva na prionovém proteinu nerozhoduje o tom, zda bude prion infekční nebo ne, přesto jde o významnou strukturu. Rozhoduje o tom, s jakými příznaky bude pacient umírat a co ukáže pitva.
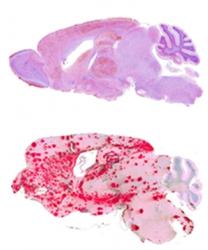
Obě skupiny myší – geneticky pozměněné i ty normální (s kotvou a bez kotvy), vystavili vědci infekci (vpravili jim do těla priony z nemocných ovcí), tedy mozkové buňky z jedince trpícího klusavkou (skrapíí). Tato nemoc je přenosná jak na skot (šílené krávy - BSE), tak na myši. Pokus trval téměř dva roky (500 dnů). V obou skupinách (normální i geneticky pozměněné) myši postupně chřadly a vyvinuly se u nich typické příznaky prionového onemocnění: úbytek na hmotnosti, zanedbávání péče o hygienu těla, ztráta koordinace pohybů a netečnost. Pitva ale poskytla obraz dvou zcela různých chorob. U geneticky modifikovaných zvířat (u nichž priony neměly kotvu), se typické díry v mozku (dosud uznávaný typický úkaz pro prionové onemocnění), neobjevily. Místo houbovitého mozku s miriádami vakuol se u nich vyvinul typický obraz cerebrální amyloidní angiopatie. Priony se zvířatům akumulovaly vně tepen, žilek a krevních kapilár, poničily je a v mozku se vytvořily amyloidové plaky.

Skupina myší „bez kotvy“ měla kromě problémů s cévami ještě jeden navíc. Ucpávaly se jim lymfatické cesty. U mozku je důležité, aby tekutina omyvající a vyživující nervové buňky po splnění svého úkolu zase odtekla. Odvodné cesty ale volně se potulující neukotvené priony ucpávaly. Z toho plyne poučení, že různé priony vedou k různým zcela odlišným projevům a můžeme je považovat za zcela odlišné choroby.
Abychom se v tom teď alespoň nějak orientovali a mohli mezi prionovými chorobami začít rozlišovat, jako vhodné kriterium se nabízí, zda vznikají plaky na krevních cévách, nebo ne. Obě cesty (jak vznik plaků, tak vakuoly v mozku) sice vedou ke stejnému konci – rozvrácení centrálního nervového systému, cesty, kterými dochází k poškození mozku a patologické nálezy, jsou ale diametrálně rozdílné. Jedna ničí nervové buňky tím, že ucpává cévy a lymfatické cesty a neurony prakticky zbaví výživy a zahubí je hladem. Při druhé formě se priony hromadí v buňce, což je nakonec také zničí za vzniku dírami poseté tkáně. O tom, která z forem nemoci se vyvine, rozhoduje zřejmě jen to, zda prionový protein kotvu má, nebo mu chybí.
Když nic jiného, tak z tohoto článku bychom si měli odnést ponaučení, že není šílenec jako šílenec a že prionových chorob bude vícero typů a že priony budou tahat za nitky i u chorob, do kterých bychom to ještě nedávno neřekli.
Tento pokus na myším modelu objasňuje případy takzvaného Gerstmann-Sträussler-Scheinkerova syndromu (GSS) u lidí, u nichž prionový protein také postrádal kotvu. Ukazuje se, že různé typy prionových onemocnění a jejich souvislost se vznikem plaků postihujících cévy bude obecnějším jevem a nebude se týkat jen myší.
Kromě filatelie v podobě nového třídění prionových chorob, by tyto poznatky mohly vést i k něčemu užitečnějšímu. Pokud by se podařilo na geneticky modifikovaných myších zabránit vzniku amyloidových plaků v mozku, je velká šance, že by šlo tlumit i vznik těchto plaků u podobně se projevující lidské choroby - u "Alzheimera" tedy nemoci, kterou na rozdíl od Creutzfeldt-Jakobovy choroby nás dávat do souvislosti s priony zatím nenapadlo.
Pramen: National Institute of Allergy and Infectious Diseases, Hamilton, Montana,