I když se vědci zatím neshodnou na původu virů, předpokládají, že vznikly v evolučně krátké době po vzniku prvních jednobuněčných organismů. Tyto velice zajímavé biologické mikročástice ignorující naši snahu jednoznačně definovat život, nalezneme v podstatě všude, kde mohou potkat svého hostitele. Je nošením dřeva do lesa na Oslu vysvětlovat, že ke své replikaci nutně potřebují vhodnou buňku, k níž mají potřebný klíč. Jakým je například všem známý spike protein koronaviru SARS-CoV-2. Tento nejčastěji zmiňovaný patogen nám všem názorně předvádí, jak jeho schopnost se šířit a přivodit onemocnění s různými příznaky ovlivňují postupně přibývající mutace (přehled variant a linií zde). Jde o koronavirus, jehož replikace by měla probíhat pouze v cytoplazmě napadené buňky. Názorná a hezky udělaná animace životního cyklu SARS-CoV-2 z nizozemské Univerzity v Maastrichtu zde.
Nicméně se ukázalo, že v krvi některých lidí, kteří onemocnění COVID překonali, ještě dlouhou dobu koluje virová RNA. Přesto, že její nositelé již nebyli nemocní ani infekční, jejich opakované PCR testy vycházely pozitivně. Vědci Harvardovy univerzity v massachusettském Cambridge již v roce 2020 tento poznatek experimentálně potvrdili i vysvětlili. Jisté formy reverzní transkriptázy, enzymu, jenž se v cytoplazmě buňky nachází jako důsledek jiné nákazy nějakým retrovirem, dokáží i koronavirovou RNA přepsat do odpovídající (komplementární) dvoušroubovice DNA, a tu pak jiný mechanismus včlení do genomu v jádře buňky. Ta, pokud žije, kopíruje spolu se svou původní jadernou DNA i tuto vpašovanou ze SARS-CoV-2 viru, jež ale nemusí být kompletní a funkční. Protože PCR testy ověřují přítomnost jen určité specifické genetické sekvence patogenu (části jeho RNA) v krvi, můžou i takovéto již nevirulentní transkripty vést k pozitivitě testů.
Koronaviry naštěstí neunikají imunitnímu systému. Z nákazy COVID-19 se člověk zpravidla zcela vyléčí. Žel to neplatí u již zmíněných retrovirů, mezi které patří například i HIV viry (Human Immunodeficiency Viruses) odpovědné za onemocnění AIDS, nebo HTLV (Lidský T-lymfotropní virus), který u velmi malé části svých hostitelů vyvolá jistou formu leukémie, myelopatie, případně jinou neurodegenerativní poruchu. Retroviry totiž do cytoplasmy napadené buňky uvolní ze svého obalu nejen RNA, tedy genetický kód pro replikaci, ale i další zlomyslné nástroje. Jedním je reverzní transkriptáza, enzym, který přepíše vetřelcovou RNA do komplementární DNA. Tu pak další propašovaný enzym, integráza, včlení do jaderné DNA. Nový cizorodý úsek, nazývaný provirus, se pak stává součástí genetické výbavy příslušné buňky. Ta však nutně nemusí podle takto získané DNA patogenu automaticky vytvářet nové retrovirové částice. Provirus může být nějakou dobu zcela neaktivní, buňka ho dokáže takzvaně umlčet. Nakažený člověk může žít zcela zdravým životem, nemít žádné projevy nemoci, ale v některých jeho buňkách čekají „rozbušky“. Nicméně se nemusí aktivovat, buňka je dokáže epigeneticky umlčet, pokud nenastanou podmínky, které to změní – například oslabení organismu věkem, případně nemocí apod. Jenže i v tom umlčeném stavu se provirus kopíruje při dělení napadené buňky a přechází do každé generace buněk dceřiných.
Jestli shodou ne zcela náhodných okolností virus zakomponuje svou DNA do buňky pohlavní, z níž se po oplození vyvine nový jedinec, stane se provirus součástí genomu nejen jeho, ale i jeho potomků, tedy se přes generace může přenášet i do širší populace. Nicméně i DNA spícího protoviru podléhá náhodným mutacím, které ho pozmění a časem zpravidla znefunkční jeho návod pro tvorbu nových retrovirů.
Je to velice zjednodušený rámcový popis, jak se v evoluční historii v našich genomech – a samozřejmě nejen lidských – postupně akumulovaly spící retrovirové sekvence – endogenní retroviry (dál i jako ERV). U mnohých došlo k repeticím – k opakujícím se kopiím. Tyto endogenní retroviry dnes tvoří přibližně 5 až 8 % naší jaderné DNA. Principiálně jsou neškodné, jak bylo zmíněno, nejen kvůli mutačním změnám, buňka je i sama epigeneticky umlčuje.
Jenže i takový bezpečnostní mechanismus se může porouchat. Jestli se to stane v embryonálních buňkách, probuzené retrovirové genové fragmenty v nich způsobí chaos. Ne samotnými proteiny, které se tvoří v cytoplazmě přepisem kódu do příslušné posloupnosti aminokyselin, nýbrž tvorbou samotných mRNA kopií virových DNA sekvencí.
"Zjistili jsme, že mediátorové (messengerové – mRNA) RNA kopie některých virových genů, mají významný dopad na embryonální buňky, " říká Denes Hnisz, vedoucí výzkumné skupiny v Oddělení pro molekulární genetiky Ústavu Maxe Plancka v Berlíně. "Zdá se, že virové sekvence si pamatují svůj původní úkol ovládnout molekulární mašinérii, která zajišťuje přepis informací z DNA do RNA a proteinu. Zajímavé je, že pravděpodobně je za to odpovědna samotná mediátorová RNA."
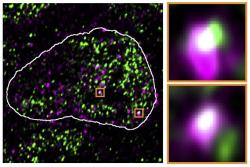
Hniszův tým ve spolupráci s dalšími kolegy z Německa i zahraničí publikovali v časopise Nature Genetics výsledky studie, v níž využili myší embryonální kmenové buňky. Zjistili, že mRNA „probuzených“ endogenních retrovirů přitahují enzymy, které čtou informace z DNA. Tím se narušuje důležitý mechanismus raného vývoje – správný přepis důležitých embryonálních genů. V buňce vzniká fatální nerovnováha, stav, který se ale vyskytuje i buňkách již vyvinutého organismu například u některých typů rakoviny, nebo některých neurologických onemocnění.
Někdy se říká, že všechno zlé je k něčemu dobré. Toto klišé zdaleka ne vždy odráží pravdu, nicméně pro endogenní retroviry platí. To, že se dokážou v rámci našeho genomu přesouvat, má svůj rub i líc. Henri Niskanen z Oddělení regulace genomu Ústavu Maxe Plancka o pozitivní stránce říká: "Jak retroviry během svého životního cyklu skáčou z jedné oblasti DNA do druhé, mohou geny měnit, dokonce je i rekombinovat. To z nich dělá důležitý evoluční nástroj pro vytváření nových genů.“ Jenže to je statisticky zřídkavým jackpotem, když výsledek takové retrovirové genetické manipulace je z evolučního hlediska výhodný. Povětšinou, jak dodává Niskanen, „nekontrolovaná modifikace genů nevěstí pro organismus nic dobrého, zejména během vývoje embrya“.
Aby vědci vybádali, co se stane, když se kontrolní mechanismy vypnou a ERV zombie se vymknou kontrole, odstranili z pokusných myších embryonálních buněk protein Trim28, který zprostředkovává umlčování genů. To způsobilo, že buňka začala ERV geny přepisovat a tvořit jejich mRNA kopie. Proč je to pro zárodeční buňku vyvíjejícího se jedince fatální? Ne proto, že by produkovala viry, ERV geny nemusí být v tomto směru již funkční. Zrada se ukrývá v samotném mechanismu přepisu DNA → mRNA. Zajišťují ho specifické nástroje, jako je RNA polymeráza a další faktory, které se v buňce vznášejí v malých shlucích a samozřejmě jen v nějakém omezeném množství. Tyto shluky jsou přednostně přitahovány těmi úseky genomu, které obsahují pro příslušné stadium dělení a specializace buňky nejdůležitější geny. Výzkum však odhalil, že díky vyšší afinitě jsou v souboji o tyto nezbytné mechanismy úspěšnější části retrovirové DNA, které se vymkly kontrole. Dostatek kopírovacího „toneru“ se pak nedostává bezpočtu vlastních genů, jejichž orchestrální souhra je zejména v počátku vývoje nového organismu klíčová. Kmenové buňky tím ztrácejí svou schopnost vyvinout se v jakýkoli specializovaný typ buňky, protože potřebné geny v důležitém okamžiku nejsou aktivní.
"Únos transkripčních kondenzátů endogenními retroviry a jejich RNA je důležitým zjištěním, s kterým je nutno počítat při budoucích studiích transponovatelných prvků a jejich epigenetických regulátorů, " říká jeden z autorů studie, Vahid Asimi. "Mohlo by jít o další způsob, kterým ERV přispívají k evolučním inovacím."
Jak ale upozorňuje šéf týmu Denes Hnisz, "reaktivace ERV je spojena s patologiemi, od obezity přes různé druhy rakoviny až po neurologická onemocnění, jako je amyotrofická laterální skleróza nebo schizofrenie. Doufejme, že náš výzkum pomůže objasnit molekulární příčiny těchto chorob."
Video: Retrovirusy
Literatura: Max-Planck-Institut für molekulare Genetik, Nature Genetics
Neandrtálské retroviry nalezeny v našem genomu
Autor: Stanislav Mihulka (19.11.2013)
Naše DNA je prolezlá více starobylými viry, než jsme si mysleli
Autor: Stanislav Mihulka (24.03.2016)
Myelin – dar od přítele "retrovira"
Autor: Josef Pazdera (04.02.2022)
Spike protein aktivuje endogenní retroviry
Autor: Josef Pazdera (12.02.2022)
Diskuze: