Alzheimerova choroba je nejčastější ze všech demencí. Představuje asi 50-60% všech případů. Jde o neurodegenerativní onemocnění, které je poměrně dobře definováno patologickými nálezy, společnými pro všechny postižené.
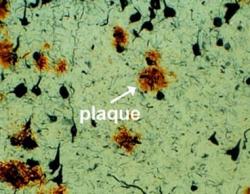
K základním projevům této choroby patří atrofie mozku, selektivní zánik především acetylcholinergních neuronů, tvorba beta-amyloidu a formace plaků. V mozkové kůře jsou při Alzheimerově chorobě pozorovány chumáče rozpadlých nervových vláken, v jejichž středu se často objevuje hrudka tvořená bílkovinou amyloidem. Protein, z něhož vzniká amyloid, je běžnou součástí membrán nervových buněk. Na vině chorobného stavu je zřejmě tvorba amyloidu v nadbytku nebo to, že se nějak jinak, neúspěšně, začne v buňkách zpracovávat a následně jeho velké množství začne poškozovat nervové výběžky. Nejvíce bývají postiženy acetylcholinergní neurony, především oblast Meynertova jádra, hippokampu a souvisejících korových oblastí.
I když se stále vedou spory o to, zda Alzheimerovu chorobu nemá na svědomí jiný patologický protein (degenerovaný tau protein), převládá názor, že primárním viníkem je beta-amyloid a jeho plaky. V oblasti mozku, kde se takové plaky vyvinou, vzniká zánět. Ten aktivuje buňky mikroglie i astrocyty. Při zánětu dochází k uvolnění cytokinů a volných kyslíkových radikálů. Ty celou situaci zhoršují. Například volné kyslíkové radikály peroxidují lipidy buněčné membrány neuronů. Postižené neurony nečeká dobrý konec. Navíc při zániku neuronů jsou nadměrně uvolňovány excitační aminokyseliny (glutamát, aspartát). Ty se v mozku váží na své receptory a to vede k jakési buněčné hyperexcitaci – otevírají se kalciové kanály a do mozkových buněk vtrhne nadměrné množství vápníku. Vnitřní prostředí neuronů se rozhádá, aktivují se enzymy proteinkinázy a to je pochod, na jehož konci je smrt dalších neuronů. Tím se do okolí uvolní další excitační aminokyseliny a spirála kaskádových reakcí se roztočí.
Tu a tam se v literatuře objeví mírný pozitivní vliv podávání různých látek, které zhoubný proces umí zpomalit. Vznik formací beta-amyloidu, jež je považován za příčinu toho všeho, však zatím výrazně ovlivnit nedovedeme.
Nový poznatek
Podle zprávy zveřejněné v posledním čísle Nature se na vzniku Alzheimera podílí také normální prionové proteiny. Jde o proteiny, jež se nám v mozku běžně tvoří. Za určitých podmínek ale reagují s beta-amyloidovými peptidy a jejich hromadění je průvodním znakem Alzheimerovy choroby. Pokusy na myších ukazují, že zabráněním interakcí mezi těmito dvěma druhy molekul zamezíme vývoji neurologických defektů, ke kterým by jinak po nahromadění beta-amyloidů došlo. Dosud jsme si mysleli, že roli v degeneraci mozku hrají pouze infekční prionové proteiny. Konkrétně u takzvaných prionových chorob. Nyní se ukázalo, že i „nezašmodrchaný“ a tudíž neinfekční, nebo chcete-li „zcela normální“ prionový protein, dokáže spolu s amyloidem také napáchat v mozku pěknou spoušť. Tentokrát ne jako prionové postižení mozku, ale ve spojení se zmíněným amyloidem jako neurodegenerativní proces typu „Alzheimera“.
Výsledky ještě nebyly potvrzeny u lidí, ale zatím vše nasvědčuje tomu, že zaměření se na ovlivnění nevhodné reakce neinfekčního prionového proteinu (PrPc) by mohlo poskytnout alternativní cestu k léčbě Alzheimerovy choroby. Tato choroba je ostatně již dlouho dávána do souvislosti s beta-amyloidními peptidy. Nemoc začíná tak, že se nám v mozku vytvoří krátké beta-amyloidní peptidy (v odborné hantýrce se jim říká oligomery) a ty se později mění ve shluky lepkavých vláken formujících se v takzvané plaky, které dílo zkázy dokonají. Možná jsou beta-amyloidy toxické již ve své krátké podobě. Jak přesně v našem mozku ale fungují, to se zatím neví. Stephen Strittmatter se svými kolegy z Yale University měli svým způsobem štěstí. Zajímali se o další proteiny, které v mozku s beta-amyloidními oligomery reagují a přitom přišli na to, že molekuly amyloidů jsou ve styku s normálním prionovým proteinem (PrPc). Tedy s neinfekčním prionovým proteinem, který v jeho infekční (zašmodrchané) formě dobře známe u nemocných s Creutzfeldt-Jakobovou chorobou, u šílených krav, u ovcí nemocných klusavkou, jelenů postižených chronickým vyčerpáním,…
Dobrý sluha, zlý pán

I když zašmodrchaný prionový protein nám škodí, tak ve své přirozené, normální formě, se nám hodí. Má na starosti formování naší paměti. Podstatou pokusů Strittmatterova týmu, kterými se jim podařilo odhalit další neblahou funkci prionového proteinu bylo, že použili geneticky modifikované myši, jež žádný prionový protein v mozku nemají. Ukázalo se to jako velmi prozíravé. V mozcích geneticky upravených myší (bez prionového proteinu) se poškození zapříčiněné beta-amyloidovými plaky neobjevilo. To lze interpretovat také tak, že tyto myši jsou vůči Alzheimerovi „imunní“. Podobné ochrany, jako je genetické vyřazení prionového proteinu ze hry, lze docílit i jinak. Nekalým hrátkám mezi prionovým proteinem a amyloidovým proteinem, které nakonec vedou k poškození mozku, lze zabránit i aplikací protilátek namířených proti prionovému proteinu. Tedy jiným způsobem provedeným vyřazením prionového proteinu z účasti na tvorbě plak. Nové poznatky nasvědčují tomu, že prionový protein i ve své přirozené neinfekční formě, hraje při vzniku Alzheimerovy choroby důležitou roli a že jeho vyřazením ze hry, ať už zabráněním jeho tvorby genetickou manipulací anebo pomocí protilátky, ochrání mozek před degenerací.
S vyblokováním prionového proteinu to ale nebude tak jednoduché, jak by se mohlo zdát. I když prvotní pokusy na zvířatech dávaly pocit, že prionový protein ke spokojenosti vůbec nepotřebují, novější pokusy na myších ukazují, že jeho nedostatek se přece jen nějak vymstí. Například mírným snížením tvorby nových neuronů a nebo zhoršenými reakcemi zvířat na stres, případně poruchou čichu. Když se ale na celou věc podíváme pragmaticky, tak v případě Alzheimerovy choroby by nás až tak moc nějaký čich trápit nemusel.
Praktické dopady
Strittmatterův tým neusnul na vavřínech a snaží se o využití svého objevu (účasti prionového proteinu při formování beta-amyloidních plak). Mapuje oblasti na molekule prionového proteinu, které s beta-amyloidem reagují. Vědci si od toho slibují případnou možnost zarazit reakci dvou proteinů a ochránit tím pacienta před poškozením mozku vznikajícími amyloidovými plaky. Určitou nadějí, že jde o správnou cestu, je poznatek účinku enzymu, zvaného alfa-sekretáza. Tento enzym dokáže prionový protein rozštěpit v místě, které je za vazbu s beta-amyloidem odpovědné. Ten samý enzym umí štěpit i samotný beta-amyloid. Zdá se, že vyburcování organismu k větší tvorbě alfa-sekretázy by mohlo být metlou, která by na Alzheimera mohla platit. V přípravě by již měly být klinické pokusy s látkami, které by měly snižovat množství beta-amyloidu v lidském mozku. Již předem ale panuje jistý pesimismus. Nepředpokládá se, že by léčba byla zcela účinná a že by se podařilo beta-amyloidové plaky z postižených mozků zcela vymýtit.
Ať již klinické pokusy dopadnou jakkoli, vědci z Connecticutu přispěli do mozaiky poznatků o Alzheimerovi dalším kamínkem a ten by nás mohl přivést ke skutečné příčině vzniku nemoci. Nemoci, která má na svědomí přes polovinu našich demencí.ˇ
Prameny: Nature, Nature Neuroscience
Diskuze: