Některé pokusy se na lidech dělat nedají. Proto se u výzkumníků těší takové oblibě pokusné organismy. K častým nereptajícím „dobrovolníkům“, jimž vděčíme za hodně, patří pruhovaná akvarijní rybička danio. Na rybičce, v anglické literatuře popisované jako zebrafish, hojně pokusničí i vědci z Duke University. Důvodem je jejich schopnost regenerovat poškozenou srdeční tkáň. Dlouho se soudilo, že regenerace probíhá tak, že se začnou dělit buňky srdečního svalu - ty, které jsou v bezprostředním okolí místa poškození.

V Duke University ale zjistili, že na místo poranění přijede spousta nediferencovaných kmenových buněk a natěsnají se tam do pořádného shluku (regeneračního pupenu, blastémy). Pak se změní v buňky srdečního svalu a srdce se tím elegantně zregeneruje. Jak se zdá, klíčový signál k regeneraci kmenovým buňkám posílají buňky membrány obklopující srdce (epikardia). Za 14 dnů se rybičkám rána s přispěním fibroblastových růstových faktorů zacelí. Z budoucího praktického hlediska je na závěrech těchto pokusů důležité, že tuto schopnost regenerace sdílel společný předek všech obratlovců, jen ji někteří z jeho potomků ztratili.
Danio vědcům z Duke neslouží jen jako slibný model léčby infarktů. Před několika dny tamní kolektiv molekulárních genetiků popsal ve Sborníku americké Akademie věd objev pozoruhodného obranného mechanismu, který nás vytahuje z jedových šlamastik. Takových, jakou je například farmakem indukovaná enteropatie. Přeloženo do lidštiny: když jde o přiotrávení přemírou léků se škodlivými vedlejšími účinky.
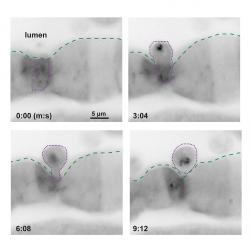
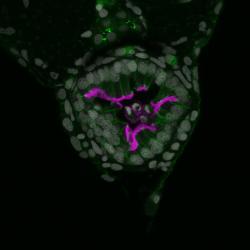
Celá desetiletí panovala představa, že pokud se do střeva dostanou toxiny, zničí nám sliznici a její buňky se začnou odlupovat a odcházejí se stolicí. Popisuje se to jako delaminace a jako něco, čemu je v rámci zachování našeho zdraví potřeba bránit. Realita delaminace je jiná. Je sice pravdou, že při některých otravách se slizniční buňky začnou odlupovat jako o závod, ale jak se nyní ukázalo, týká se to jen „vybraných“ střevních buněk a označkovaných jistým proteinem. Nikoli jedová substance, ale povrchový protein nějak zajistí, že se některé z buněk stanou v kolektivu neoblíbenými a ten je ze svých řad vypudí. Týká se to buněk „hamižníků“, kteří si nepatřičného do svých útrob nasáli víc, než je zdrávo. Pokud by tyto buňky zůstaly naživu tam, kde jsou a soukmenovkyně by se jich nezbavily, toxická substance by časem zaplavila a otrávila celé tělo.
Ve zmíněném cejchování buněk specifickým proteinem může být i trocha furiantství a altruismu. Možná se buňky samy dobrovolně rozhodují vzít na sebe úlohu spasitelek a záměrně do sebe cpou co nejvíc škodlivin, aby za cenu sebevraždy ulevily celku. Ať už je tomu jakkoliv, důležité je, že tento typ apoptózy funguje nejen u ryb, ale i u nás.
Hromadné odloupávání střevních buněk tedy není tím, za co jsme ho měli. Neškodí a netřeba mu bránit. Opak je pravdou, je to důmyslný obranný nástroj, který nás umí zbavit, ne sice „ode všeho zlého“, ale řady toxinů zcela určitě. Příkladem je substance léku proti bolesti Glafenin. Užívání tohoto preparátu bylo u nás v Evropě v oblibě po tři desetiletí. Teď už je ale stažen kvůli poškozování ledvin a jater. Mnoho z nás nejspíš vděčí právě mechanismu delaminace, že jsme léčbu tímto nesteroidním protizánětlivým lékem přežili.
Jak to funguje?
Střevní výstelku tvoří jediná vrstva těsně spojených tyčinkovitých buněk. Tak tenká je proto, aby prostup živin byl co nejsnazší. Ztluštělé střevo, například záněty, přestává být výkonným orgánem a potravou plýtvá. Aby tenká vrstvička slizničních buněk nápory všeho druhu ustála, jsou buňky k sobě těsně přimknuty a k podloží fixovány pevnými kotevními proteiny. Když se z některé stane „pohár plný jedu“, začnou na ní její zdravější kolegyně tlačit a nějak ji přinutí zvednout kotvy – její vazebné proteiny se uvolní a protáhnou. Na odsouzenkyni se ze stran začnou tlačit sousedky, až ji ze svého společenství vystrčí, čímž nad ní vynesou rozsudek smrti v prostředí odcházejícího odpadu.
Čím je tento mechanismus zajímavý?
Třeba tím, že je řešením v situacích, kdy nežádoucí účinky léků (jako v případě zmíněného léku Glafenin) zastaví takzvané efluxní pumpy. Ty je dobré je mít funkční, neboť nám odstraňují škodliviny z buněk. Pronikat do tajů efluxních pump je dobrým počinem. Může se hodit v případech, kdy je žádoucí jejich výkon záměrně snížit. Například v situacích, kdy se aplikuje chemoterapie, od níž potřebujeme, aby s rakovinou udělala krátký proces. Problém je v tom, že právě zvrhlé buňky si často dovedou výkon svých efluxních pump zvýšit a tím odolat i takovým jedovým koktejlům, které si zdravé buňky vypumpovat z těla nezvládnou. Vědci přiznávají, že zatím neví, které ze střevních slizničních buněk odcházejí a na jaký pokyn se tak děje. Nicméně i tak se jejich poznatek může hodit v lepším pochopení alimentárních otrav, v boji s alergiemi a možná i rakovinou.
Literatura
Scott T. Espenschied, et al.: Epithelial delamination is protective during pharmaceutical-induced enteropathy, PNAS first published August 7, 2019 https://doi.org/10.1073/pnas.1902596116
