Superstar mezi včelími parazity a patogeny je roztoč Varroa destructor (česky kleštík včelí), který se živí na včelím plodu a zároveň funguje jako vektor (mimo jiné) viru deformace křídel (deformed wing virus, DWV), další metly včely medonosné. V současné době je hlavní zbraní s varroázou použití akaricidních látek, které ovšem mají tu nevýhodu, že si proti nim Varroa vyvíjí rezistenci. Zdá se ale, že by se včelám a včelařům mohlo blýskat na lepší časy, protože Sean P. Leonard a jeho kolegové vyvinuli zbraň, která cílí hned na oba výše zmíněné prevíty najednou.
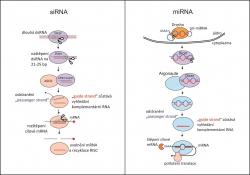
Eukaryotické organismy mají ve svých buňkách obranný systém proti cizí RNA, především virové, který se nazývá RNA interference (RNAi)(obr. 1). Funguje tak, že se cizí dvouřetězcové RNA (dsRNA) zmocní buněčný enzym Dicer, který jí rozseká na úseky dlouhé cca 21 bází, takzvané siRNA (small interfering RNA). Ty jsou následně naloženy na proteinový komplex RISC (RNA-induced silencing complex), kde je odstraněn jeden řetězec ze stále ještě dsRNA fragmentu, zatímco druhý řetězec slouží jako matrice k hledání komplementární RNA. Jakmile je taková RNA v buňce nalezena, je rozštěpena a tím pádem nemůže nadále sloužit jako genetická informace. Technologii RNAi ale buňka používá i k posttranskripční regulaci vlastních genů neboli k tomu, aby zabránila vzniku proteinu podle genu, který už byl přepsán do mRNA. Za tímto účelem vyrábí vlastní tzv. miRNA (microRNA) pomocí speciálních genů. Jejich přepisem vznikne dvouřetězcová RNA. Ta je po úpravě rozštěpena enzymem Dicer na malé fragmenty, které jsou poté naloženy na RISC a zpracovány podobně jako v předchozím případě. Tentokrát je RISC naveden k mRNA, která vykazuje komplementaritu k miRNA. Tato mRNA je buď rozštěpena, nebo vyloučena z translace. Tak či tak jako potenciální matrice pro syntézu proteinu skončila.
RNAi se využívá i jako nástroj v molekulární biologii, pokud chcete vypnout určitý gen (bez toho, že byste ho zlikvidovali) a zjistit, co to udělá. Stačí buňce podstrčit námi vyrobenou dsRNA, komplementární k mRNA, vzniklé přepisem sledovaného genu. Pro účely léčby včel, je ale dsRNA potřeba hodně. Výroba velkého množství dsRNA je nákladná a RNA dlouho nevydrží. Také může být problém doručit tuto RNA v dostatečném množství do buňky.
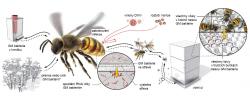
Vědci si proto vzali na pomoc betaproteobakterii Snodgrassella alvi, která žije ve včelím střevě, a vložili do ní upravený plazmid, kruhovou molekulu DNA, podle které pak mohla bakterie ve včele vyrábět dvouřetězcovou RNA. Plazmid obsahoval buď části genů z V. destructor nebo z DWV nebo kontrolní kousek genu pro oblíbený zeleně fluoreskující protein (GFP) z medúzy.
Badatelé během experimentu nejprve včely nakrmili bakteriemi s plazmidem a za nějakou dobu je nakazili virem. Zatímco kontrolní včelky, které v sobě měly bakterie s plazmidem nesoucím GFP, hynuly podobně jako včely bez plazmidu, včelám, v nichž byly bakterie s plazmidem pro anti-virovou sekvenci, se dařilo výrazně lépe. Podobně povzbudivé výsledky vědci obdrželi u pokusů s varroázou, kdy roztoči na včelách s bakterií nesoucí plazmid pro sekvenci z roztoče hynuli rychleji než ti na kontrolních včelách. Roztoči Varroa se totiž živí na tukovém tělese včel, kde se jim v experimentu do těla dostala dsRNA vyrobená bakteriemi S. alvi, která, ač produkována bakteriemi ve střevě, byla nalezena v různých dalších částech včelího těla. Jakmile byla dsRNA v roztoči, spustila v jeho buňkách mechanismus RNAi, který následně zlikvidoval transkripty 14 životně důležitých genů roztoče. Dlužno podotknout, že včelám tato obrana nic zlého nedělá.
Metoda tedy funguje. Její výhodou je i to, že včely jakožto sociální hmyz žijící ve velkých koloniích provozují množství vzájemného krmení a čištění, takže si modifikované bakterie mohou předávat navzájem (obr. 2). Autoři ale zároveň sami upozorňují, že cesta k praktickému využití těchto modifikovaných bakterií je ještě dlouhá a zbývá hodně práce. Bude nutné ověřit přenos bakterií mezi včelami na celé kolonii a také mezi úly, zvýšit účinnost přenosu dsRNA, atd.
Co se týče samotné S. alvi, je to bakterie, jejíž kmeny jsou věrné svému hostiteli a přenos na jiné druhy hmyzu tedy patrně nehrozí. Ale bakterie jsou slavné svým uměním horizontálního přenosu genů, takže se obranný plazmid nebo jeho část může dostat i do jiné bakterie a tím i do jiného hostitele. Problém, který rovněž může zkomplikovat případné využití tohoto systému je fakt, že S. alvi s upraveným plazmidem se stává geneticky modifikovaným organismem, a vypuštění GMO do volné přírody je vždy provázenou velkou ostražitostí a často nevůlí veřejnosti. Na druhou stranu, tato potenciálně jednoduchá, účinná, relativně levná a snadno aplikovatelná metoda by mohla přinést úlevu zuboženým včelám prožívajícím globální krizi. Elegantní na tom je, že zbraň už včely mají. My jim jen ukážeme, na co mají mířit.
Literatura:
Leonard et al. (2020) Engineered symbionts activate honey bee immunity and limit pathogens. Science 31: 573-576. DOI: 10.1126/science.aax9039
Paxton (2020) A microbiome silver bullet for honey bees. Science 31: 504-506. DOI: 10.1126/science.aba6135
