Když si budete listovat učebnicemi chemie, zjistíte, že v zápisech rovnic přeměn látek z jedné na druhou figurují čistě značky chemických prvků. Není obvyklé, aby tyto symboly byly doplněny o upřesňující informaci udávající počet nukleonů v jádře, jako tomu bývá u schémat jaderných reakcí. To protože elektronová konfigurace izotopů stejného prvku je identická a při chemických dějích se přeuspořádávají elektrony z atomového obalu nikoliv protony a neutrony z atomového jádra.
Chemici ale důsledky rozdílu hmotnosti mezi atomy stejného prvku nemohou hodit úplně za hlavu. Lehčí a těžší izotop bude mít pochopitelně odlišné fyzikální vlastnosti, což se přelévá v návaznosti do fyzikálně-chemické roviny a přes ní se dostáváme k pozměněným vlastnostem chemickým. Byla by to ryze akademická debata, kdyby se počítalo vždy s přírodní směsi izotopů, která má pořád stejné izotopické složení a tím i stejné chování, ale izotopy umíme separovat do čisté podoby a provádět s nimi různé kejkle, které svět chemie činí zábavnějším.
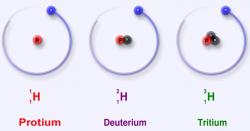
Největší kontrast je mezi izotopy vodíku
Ne u všech prvků se diference v nukleonovém čísle projevuje tak výrazně. Největší rozdíl hmotnosti mezi jednotlivými izotopy nastane u nejlehčího prvku vodíku. Hojnější izotop vodíku protium obsahuje v jádře jeden proton. Pokud v jádře protia přibude jeden neutron, stane se deuteriem a jeho hmotnost vzroste téměř dvojnásobně. Skutečnost například výrazně ovlivní hmotnostní reakční poměr. Takže spálení jednoho gramu protia na vodu spotřebuje 8 g kyslíku, zatímco úplná oxidace jednoho gramu deuteria spolkne kyslíku poloviční množství (4 g).

Menší dopad má jeden neutron navíc na fyzikální veličiny. Sloučenina deuteria s kyslíkem těžká voda vře při teplotě jen 1,4 °C nad bodem varu vody normální. Přesto opakovaným destilačním procesem objeveným alchymisty, lze těžkou a lehkou vodu oddělit. Zastoupení deuteria ve vodíku na Zemi je okolo 0,015%, proto dá separace velkou dřinu a vynaloží se na ni mnoho energie. Avšak pořád je to snadnější úkol než separovat od sebe izotopy uranu 235 a 238, mezi nimiž je sice rozdíl tří neutronů, ale tato změna s celkovou hmotností jádra příliš nezahýbe, což je štěstí, jinak by primitivní destilační baňky zahříval kdejaký pomíjivý vládce přesvědčený o tom, že to poslední, co mu chybí k nastolení ráje v jeho zemi, jsou atomové zbraně.
Toxicita těžké vody
No dobře teploměr, hustoměr a jiné měřáky deuterium poznají. Co živé organismy nechají se ošálit? Vezmou deuterium za rovnocenného partnera protia? Pokusy prováděné s těžkou vodou na zvířatech ukázaly že nikoliv. Biochemické pochody jsou jemně vyladěny a podstrčit jim atom s odlišným chováním je stejné, jako vložit do soukolí hodinového strojku místo maziva písek. Pokud si dáte jednu, dvě, či mnohonásobně víc sklenic těžké vody, nic pozorovatelného se nestane. Horší bude, když v tom cílevědomě budete pokračovat a postupně nahrazovat lehkou vodu obsaženou v organismu. Jakmile se dopracujete k 25 % zastoupení těžké vody v těle, vaše buňky začnou mít problém s dělením a stanete se sterilní nehledě na pohlaví. Smrt nastane, až obsah těžké frakce vyženete nad 30 %. Způsobí ji zastavení dělení buněk v kostní dřeni. Majoritní přítomnost těžké vody v prostředí přežijí jen jednobuněčné organismy. Řasy a bakterie dokonce tolerují koncentraci stoprocentní, i když pak pomaleji rostou. O toxicitě těžké vody pro mnohobuněčné tvory není pochyb, přesto jak už bylo naznačeno, chcete-li napsat detektivní román, kde se bude vraždit běžnými postupy nezjistitelným hrůzostrašným jedem, těžká voda nebude ten pravý prostředek zkázy. Vždyť k zaujmutí neškodné desetiprocentní úrovně by člověk o hmotnosti 70 kg potřeboval rychle vypít 5 litrů otravné tekutiny.
Mechanismus toxicity není výzkumy rozveden do úplných podrobností. Vliv těžké vody se uplatňuje zajisté na mnoha místech, protože deuterium oxid jakožto rozpouštědlo stabilizuje hydrofobní interakce proteinů, což může narušovat jejich správnou funkci. Mimochodem tohle vůbec není k zahození. Připraví-li se vakcína konzervovaná těžkou vodou, vydrží účinná po dlouhou dobu i bez chlazení (platí pro jakýkoliv jiný biologický materiál). Dále přítomnost deuteria v organismu vede nevyhnutelně k začleňování těžšího izotopu místo protia do rozličných látek tělu vlastních, což rovněž sebou nese následky na životní pochody. Proč?
Deuterium zpomaluje reakce
Tu se dostáváme k té zajímavější fyzikálně-chemické části věci nepostradatelné k pochopení metody vylepšování léčiv. Další místo projekce ztěžknutí vodíku o nukleon zahrnuje vzrůst disociační energie vazeb. Polopatisticky vyjádřeno obecně všechny chemické vazby, které deuterium tvoří jsou pevnější než odpovídající vazby, na nichž se účastní protium. Konkrétně u organických látek vazba deuterium-uhlík má asi o třetinu větší excitační energii než protium-uhlík. To má za následek, teď se držte, 6-10násobné zpomalení reakční rychlosti.
Variabilita v rychlosti reakce lehkého a těžkého izotopu dostala označení kinetický izotopový efekt. Stala se nenahraditelným nástrojem pro objasňování reakčních mechanismů organických látek, kdy se porovnávají rychlosti chemické přeměny látky na určitém místě modifikované těžším izotopem s látkou nemodifikovanou. Pokud měření kinetiky reakce vyjde rozdílně, je jasné, že dané místo záměny je přímo zapojeno do chemické reakce.
Přínos deuteria farmacii
Kinetický izotopový efekt upoutal také výzkumníky v oboru farmacie. Došlo jim, že zavedení deuteria by mohlo ochránit léčiva před metabolickým rozkladem podmíněným přerušení vazby C-H a přitom neovlivnit biologický účinek, neboť tvar molekuly důležitý k zapadnutí klíče (léčiva) do zámku (cíle) zůstane zachován. Vytrhlo by to trn z paty lékům, které od prvních okamžiků vstřebání z trávicí soustavy podléhají rapidnímu metabolickému odbourávání, a proto se musí užívat vícekrát denně. Nastražené deuterium v kritickém místě počátečního metabolického napadení zpomalí eliminaci léčiva v těle, čímž prodlouží působení a redukuje potřebu vzít lék klidně na dvakrát nebo jedenkrát denně. Může se to zdát jako hloupost, ale není. Pro pacienta představuje nutnost častého užívání jisté nepohodlí a s přibývajícím počtem denních dávek klesá ochota pokračovat v léčbě a zvyšuje se pravděpodobnost vynechání dávky.
Zpomalení metabolizace neznamená pouze snadnější dodržování léčebného režimu pro zapomnětlivé pacienty. Také přináší potencionální výhody zvýšené účinnosti, snášenlivosti a bezpečnosti, jež pramení z toho, že se do organismu vnáší méně cizorodé látky. Trávicí soustava je méně zatížena původní látkou a tělo se na systémové úrovni potýká s nižší koncentrací metabolitů. Má to rovněž příznivý dopad na závažnost interakcí s jinými léky a vyhlazují se individuální rozdíly v rychlosti s jakou je léčivo eliminováno u jednotlivých pacientů.
Deuterium udrží stabilní konfiguraci léku v těle
Trošku z jiného soudku výhod vylepšení pochází stabilizace konfigurace na chirálním uhlíku, která zahrnuje užší okruh léčiv. Vezměme to popořádku. Uskupení atomu uhlíku s navázanými různými zbytky dovoluje zaujmout v prostoru dvě zrcadlové konfigurace lišící se od sebe jako levá a pravá ruka. Ačkoliv nazýváme obě identicky, slovem ruce, nejsou zaměnitelné.
Z toho důvodu asymetrii na uhlíku definujeme buď jako pravotočivou (R konfigurace) nebo levotočivou (S konfigurace). Bývá pravidlem, že R a S forma téže látky mívá různé biologické účinky. Mnohdy jedna konfigurace oplývá žádaným účinkem a druhá ho vůbec nevykazuje. To ještě je docela neškodný případ. Také je možné, aby jedna forma léčila a druhá zabíjela. Používání léčiv čisté konfigurace R nebo S tak představuje velkou výhodu. Výrobci to ví a čím dál častěji s pokrokem v organické syntéze uvádějí na trh takto modernizované léky, které se dříve prodávaly jako racemická směs (poměru R:S 1:1). Například poslední dobou v televizi běží reklama na nový přípravek s obsahem 200 mg S-ibuprofenu. Tableta klasického starého ibuprofenu přitom obsahuje 400 mg racemické směsi R, S. Navzdory rozdílu v hmotnosti aktivní látky jsou si prostředky v analgetickém efektu rovny, ale zažívací systém lépe snáší pilulku s čistým S-ibuprofenem.
Bohužel stejná strategie selhává u léčiv s chirálním centrem, na němž je zavěšen kyselý vodík. Takové sloučeniny pomaleji v roztoku a velmi rychle v organismu ztrácejí optickou čistotu až do bodu, kdy se z nich stane racemická směs. Jediné řešení tohoto problému nabízí zavedení deuteria do centra chirality. Silná vazba zamezí nevítaným přesunům vodíku a spolehlivě stabilizuje léčivo ve vytoužené konfiguraci.
V klinickém hodnocení se nachází aktuálně jedna molekula popsaný trik využívající. Dospěje-li do stádia medikamentu, bude pomáhat u diagnózy znějící nealkoholické ztukovatění jater. Návrh vychází z pioglitazonu dostupného od roku 1999 k léčbě diabetu druhého typu. Objevují se po něm závažné vedlejší účinky včetně přibírání na váze, otoků a řídnutí kostí. Všechny jsou vázány na S formu. Její vyloučení z léku dovolí vyniknout pozitivnímu vliv R formy na játra u zmiňovaného ztukovatění bez vedlejších škod, pouze pokud bude stabilizovana deuteriem, které zabrání převrácení konfigurace při přesmyku z ketonu na enol a zpátky.
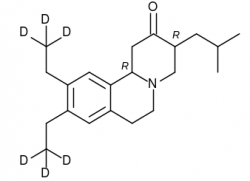
První lék
Nejpodivnější na tom celém je, že zavádět deuterium do farmaceutik vůbec není čerstvá myšlenka. Návrhy deuterovaných léčiv jsou tu s námi už více než padesát let. Ty se ovšem nikdo neodvážil dovést do zdárného konce. Záplava invence zůstala jen ve snech a na papíře, kromě fludalaninu (3-fluor-2-deutero-d-alanin). V sedmdesátých letech se dostal až do třetí fáze klinického testování. Molekula vykazovala slibné antibakteriální vlastnosti, ale také značnou toxicitu přisuzovanou metabolitu a od deuterované verze se očekávala šetrnost. Předpoklad se nenaplnil a zájem o deuterované analogy farmaceutické společnosti opět oživily přibližně před patnácti lety.
Prvním schváleným deuterovaným lékem se stal v roce 2017 Austedo s aktivní látkou deutetrabenazin od Izraelské farmaceutické společnosti Teva indikovaný pro léčbu mimovolných pohybů souvisejícíh s Huntingtonovou chorobou a tardivní dyskinezí. Farmakologický profil deutetrabenazinu, který Teva získala koupí společnosti Auspex za 3,5 miliardy dolarů, vylepšuje šest atomů deuteria na dvou methylových skupinách. Původní látku tetrabenazin využívá medicína od šedesátých let. Nejprve se zavedl jako antipsychotikum. Později změnil zaměření na výše uvedené symptomy.
Ze starého nový
V obecné rovině je „upcyklování“ obnošených léků pomoci deuteria velmi lišácká strategie. Není nutné vytvářet něco zcela úplně nového, přesto výsledek je podobný. S menší nikoli zanedbatelnou investicí do provedení nezbytných testů k registraci přípravku se z letitého léku stane novinka, jejíž vlastník tím získá pětiletou exkluzivitu, během níž nikdo jiný nesmí přijít na trh s lékem obsahujícím stejnou účinnou látkou, i když deuterium prostému předchůdci o stejné struktuře vypršel nárok na patentovou ochranu před několika desetiletími.
Představte si, jaké při nastíněném scénáři musí zažívat rozčarování subjekty, co zaplatily vývoj původních látek? Mrzet je to nebude tolik, pokud patent pozbyl platnosti. Ale co v opačném případě? Lze připustit možnost, že někdo se pokusí patentovat deuteriem modifikovanou látku, na jejíž originální verzi stále platí patentová ochrana. I když úspěch patentového řízení v takovém případě není zaručen a spíš je nepravděpodobný obzvláště při právní bitvě, tak velké farmaceutické společnosti podávají patentovou přihlášku na všechny zajímavé deuterové analogy, aby nepřipustily sebemenší prostor pro nepřátelské manévry.
S deuterovanými léky se roztrhne pytel
První vlaštovka vzlétla a další nenechají na sebe dlouho čekat. Koncem minulého roku již vstoupilo do klinického testování 20 zástupců a z toho šest se účastnilo poslední třetí fáze klinického testování. Některé snahy připomínají pokus o magickou transmutaci ve zlato kamenem mudrců. Společnost Avanir Pharmaceuticals by lék objevený roku 1954 dextrometorfan (DXM) k tlumení suchého kašle ráda povýšila na prostředek proti depresi, schizofrenii a neurodegenerativním onemocněním. Slabinou DXM je rychlá přeměna na nechtěný psychoaktivní metabolit. Na ni našli odborníci záplatu v podobě chinidinu blokujícího degradační enzym. Jenže chinidin není žádné neviňátko. Kompromituje ho jeho vlastní efekt na srdeční sval. Těžký analog DXM dovolí v kombinaci snížit množství chinidinu na zcela bezpečnou úroveň.
Naštěstí se činy neomezují striktně na obnovování zašlého lesku molekulárních starožitností. Mezi farmaceutickými sázkami najdeme třeba inovativní zbrusu nový nápad vystupující pod kódem RT001 k léčbě Friedreichovy ataxie. Přírodní varianta farmaceutického kandidáta RT001 je prachobyčejná kyselina linolová, kterou výlučně přijímáme potravou a je součásti buněčné membrány. Vyznačuje se přítomností dvou dvojných vazeb, což ji uděluje náchylnost k tvorbě radikálu, jež může iniciovat řetězovou reakci ničící membránu. Peroxidace lipidů patří k přirozeným dějům, ale u Friedreichovy ataxie je v důsledku dědičně neschopnosti adekvátně vázat železo nadměrná a způsobuje progresivní poškození nervového systému. Deuteriem obsazený problematický uhlík sousedící s dvojnými vazbami má začátku destruktivní kaskády zabránit.
Závěr
Ačkoliv lidstvo ovládlo dovednosti a znalosti k úspěšnému nasazení deuteria ve farmacii již před nějakou dobou, nedošlo během těchto dekád značně plodné vědecké práce k upoutání zájmu komerční sféry. Nyní to vypadá, že opožděnému velkému třesku v oblasti už nic nezabrání. První lék existuje a vypuštěný džin se do láhve nevrátí, protože nikdo nechce být za loudavého aktéra v adopci módních trendů.
Literatura:
https://www.chemistryworld.com/features/2heavy-drugs-gaining-momentum/1010186.article
doi: 10.1139/y99-005
doi:10.1038/nbt0617-493
doi:10.1021/acsmedchemlett.0c00052
doi:10.4155/fmc-2019-0183