Při cestách za hranice všedních dnů se mnohým účastníkům zájezdu dostává osobní zkušenosti s faraonovou kletbou, případně pomstou Montezumy, což se pro ně z celé dovolené stane tím nejintenzivnějším zážitkem. Asi nejhorší na takových zkušenostech je, že ani jako vyléčení si nemohou být jisti, zda ke kritickému střevnímu zánětu nedojde znovu. Roušku nad tajemstvím recidiv se nyní podařilo poodhrnout švýcarským expertům z Basileje.

Vysvětlit, proč je někdy léčba antibiotiky neúčinná a proč se léčivá substance ke všem bakteriálním buňkám nedostává v dostatečném množství, se snaží vysvětlit celá řada teorií. Jako příčina se zmiňuje bariera snížené propustnosti některých tkání. Jindy se argumentuje schopností bakterií utlumit svůj metabolismus natolik, že i když je kolem jedovatě působících látek hodně, přes membránu si jich do buňky pouští jen takové množství, s nímž nemají problém se vypořádat. Další z teorií pro změnu spatřuje důvod ve zpomalení proliferace navozené stresem a nízkou hladinu adenosintrifosfátu. Popsán byl také ochranný vliv asymetrického buněčného dělení, nerovnoměrné rozdělení efluxních pump mezi dceřiné buňky a řada dalších mechanismů umožňujících bakteriím přežít smrtelné koncentrace antibiotik.
Švýcarský výzkumný tým si na objasnění záhady - proč ani prodloužená terapie nedokáže patogen vymýtit, vzala na pomoc jeden z nejnovějších technologických vynálezů zvaný „STP“ - Serial two-photon tomography - česky dvoufotonová tomografie. Generuje datové soubory, z nichž lze následně získat obrázky s vysokým rozlišením a bez zkreslení. Zkoumaná tkáň se dá virtuálními řezy krájet, čímž vznikne trojrozměná mapa. Dosažené rozlišení je dostatečné k tomu, aby se daly vizualizovat dokonce i jednotlivé buňky. Jinak řečeno, před takovým optickým porcováním tkáně nemá šanci se schovat ani jediná bakterie.

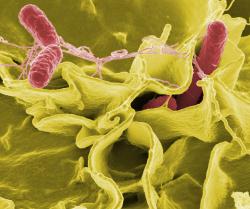
Protože provádění pokusů na lidech, zvláště když jde o salmonely, se nesetkává se zájmem ze strany pacientů, vědci si ke spolupráci vybrali hlodavce. Na oblíbeném myším modelu potom testovali patogen náležející k lidským nejobávanějším - Salmonella enterica Typhimurium.
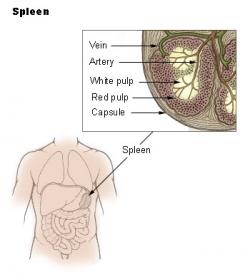
Pomocí nové techniky vědci získávali v orgánech přehled o přítomnosti salmonel v koncentracích tak nízkých, jako jedna bakterie ve 100 mm3 tkáně. Umožňovalo to pátrat po příčině, proč se salmonelám daří unikat i při razantní antibiotické léčbě. Ukázalo se, že za tím stojí slezina. Nikoli ale celá, nýbrž jen její část zvaná bílá pulpa. Ta je protkána hojnými lymfatickými cestami a uzlíky plnými bílých krvinek. Převažují B lymfocyty, další z hojně zastoupených buněk jsou makrofágy a dendritické buňky. Všechny jsou známy jako typičtí účastníci zánětlivých reakcí.
Antibiotika jsou pro léčbu bakteriálních nemocí neocenitelnými pomocníky. V případě sleziny ale nyní vyšel na světlo zádrhel. Tamní přirozený imunitní systém se při jejich použití doslova zhroutí. Na první pohled to patrné není, neboť počty salmonel v organismu při léčbě antibiotikem začnou rychle klesat. Stejně tak kvapem začnou mizet i zdravotní potíže. Problém je v tom, že i za tohoto zlepšujícího se stavu, se salmonelám v bílé pulpě sleziny daří vcelku dobře a po vysazení léčby jim nedělá větší problém se znovu zapojit do hry, případně svému dobrodinci celou veselou záležitost i vícekrát zopakovat.
Kromě toho, že se výzkumníkům podařilo odhalit, že v bílé pulpě je pro salmonely něco jako imunitní tma, se jim další metodou histochemických reakcí podařilo zjistit, kde přesně se tam salmonely schovávají. A je to překvapení. V oněch, pro ně krušných antibiotických dobách, si salmonely lebedí uvnitř buněk zvaných makrofágy. A protože makrofágy jsou jednou z opor imunitního systému a slezina je považována za jedno z jeho nejdůležitějších sídel imunity, není divu, že sami autoři studie o salmonelách prohlašují, že se dokáží schovávat přímo v „policejním ředitelství“. V odborné hantýrce to ale zpřesňují na makrofágy s exprimovaným glykoproteinem CD68 +….

Výzkumníci tomu zprvu nechtěli ani věřit, ale i další pokusy jim potvrdily, že jde skutečně jen o makrofágy a nikoli jiné typy bílých krvinek, jakými jsou B nebo T buňky (po staru T a B lymfocyty). A že útočiště salmonelám neposkytují ani folikulární dendritické buňky. Vyškrtnout museli i z původně podezřelých monocyty a stejně tak i lymfatické epiteliální buňky a fibroblasty.
Poznání, že se patogenům daří útok antibiotik ve slezině ustát (konkrétně v lokalitě bílá pulpa) a že je to díky tamním makrofágům, je zajímavé. Důležitější z pohledu praxe ale bylo zjistit, proč tam antibiotika na salmonely „nedosáhnou“, když jich krev do sleziny přináší habaděj. I to se jim nakonec vypátrat podařilo. Antibiotika sice do sleziny proudí v hojné míře, ale ne do všech míst. V případě bílé pulpy už to není prostřednictvím krevních vlásečnic, ale pouhou difúzí. Vyšetření ultrazvukem odhalilo, že salmonely se svým množením úspěšně starají o to, aby v cévách sleziny navodily rozsáhlou trombózu, což tamnímu krevnímu oběhu také zrovna neprospívá a snižuje přísun antibiotik.
K čemu jsou nové poznatky dobré? Třeba k tomu, že ukazují cestu, jak vybírat chemoterapeutika k léčbě salmonelových nákaz. Že volba podle jejich účinnosti v kultuře na Petriho misce, nebo podle toho jak rychle po jejich podání klesá počet salmonel v krevním oběhu, nejsou tím pravým ořechovým. Že lepší volbou bude jejich schopnost difundovat do trombózou poničených tkání sleziny.
Ani to ale není vše. I u antibiotika a jeho dávkování bude potřeba brát ohled na to, jak razantně tlumí zánět. Pokusy na myších totiž ukázaly, že zánět probíhající ve slezině při salmonelóze je věc nadmíru prospěšná. Ano, nejde o špatný překlad původního zdroje. Průvodním znakem zánětu je totiž zvýšená koncentrace neutrofilů a monocytů. Utlumením zánětu dochází k výraznému poklesu těchto buněk a právě v tom je čertovo kopýtko. Bez jejich spolupráce se i antibiotická léčba salmonel míjí účinkem.
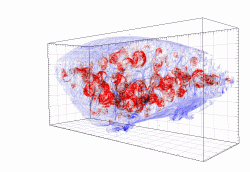
To, že je zánět v případech bakteriálních infekcí pozitivum, již prokázali i jiní autoři a snaha byla využívat to i při léčbě salmonelózy. Například injekcemi usmrcené salmonely nebo purifikovaného lipopolysacharidu (LPS). Což o to, ke stimulaci imunitního systému po takových injekcích dochází, ale moc to nepomáhá. Vědci nyní odhalili proč. Tyto injekčně aplikované látky (lipopolysacharidy) jsou zachyceny všude možně, jen se nedostávají tam, kde by je bylo nejvíc třeba – ve slezině. Jinak řečeno, aktivuje to imunitní buňky, jen ne v místech, kde by byly žádoucí (v bílé pulpě) kde se salmonely v makrofázích ukrývají. Pokud bychom si to všechno hodně zjednodušili, tak nám nové poznatky říkají, že ani tak moc nezáleží na účinnosti medikamentu, ani na tom zda „chytneme“ salmonelu normální, nebo rezistentní. Rozhodujícím pro celkové vyléčení se ukazuje být to, zda se podaří nevyřadit (ať už nevhodným časováním, nebo příliš razantním přístupem) náš imunitní systém ze hry. Samotnými antibiotiky zvládnout salmonely nelze. Spoluúčast neutrofilů a monocytů při likvidaci nepřítele ukrývajícího se v samém ředitelství imunitního systému, se ukázala být nepostradatelnou.
V řeči odborníků to znamená soustředit se například na stimulaci neutrofilů, což je strategie s nadějnými výsledky zaváděná v poslední době jako doplňková léčba rakoviny. Udělátkem, kterým lze imunitu pošťouchnout k vyššímu výkonu, je v tomto případě neutralizační protilátka, která potlačuje účinek cytokinů (například TGFβ) které mají na funkci neutrofilů neblahý vliv.
Další slibnou látkou je superantagonista interleukinu (konkrétně IL-15). Jeho efekt spočívá ve stimulaci přirozených zabíječských schopností neutrofilů. Nejspíš se brzo najdou i další cesty jak zachraňovat životy v případě těžkých sepsí a nešťastníky, kteří si z dovolených kromě jiného, přivezou i nějakou tu bakteriální nepříjemnost, zbavovat recidiv.
Závěr
STP tomografie se ukázala být metodou, která posouvá naše poznání o velký kus vpřed a dává odpověď na otázku, proč je někdy léčba bakteriálních infekcí neúčinná. I když se článek týká jen kritických míst recidivující salmonelózy, podobně by tomu mohlo být i u dalších obtížně léčitelných infekcí stafylokoků, tuberkulózy,... Už teď je jisté, že o tomografii STP ještě uslyšíme a budeme psát brzo znovu.
Pouhých několik dnů po zveřejnění švýcarské studie dokládající schopnost STP tomografie, její preciznost překonali japonští vědci. V článku uveřejněném v časopise Science popsali metodu, která dovoluje zobrazit v buňkách i jednotlivé organely. Dá se namítnout, že totéž již zvládaly i jiné techniky skenovací mikroskopie. To je sice pravda, ale tentokrát k tomu nebylo třeba nechávat buňky zmrazit v tekutém dusíku, nebo je vysoušet, případně pokovit, aby je pak (notně poškozené) bylo možno pitvat. Ani nebylo potřeba do buněk vpravovat barvičky, které se na struktury uvnitř buňky navazují a činí je tím pozorovatelné ve fluorescenčním mikroskopu. Sledovat chování organel „v přímém přenosu“ se zatím moc nedařilo. Nynější filigránská technika umožňující zkoumat dynamiku organel v živých buňkách, se nazývá nanoendoskopie AFM. Její princip není nový. Vychází z techniky zvané mikroskopie atomárních sil, při níž skenující sonda se těsně přibližuje zkoumanému vzorku. V Japonsku ale vše vylepšili natolik, že sondu vkládají přímo do živých buněk.
Zatímco STP tomografie (o níž referoval text o salmonelách) umožňuje sledovat například replikaci jednotlivých buněk, nanoendoskopie dovoluje pozorovat, co se při tom děje uvnitř buňky. Není pochyb o tom, že se obě metody mocně zapíší do pokroku v biologii i medicíně. Nebude na škodu další práci obou týmů sledovat a jejich doporučeními se také řídit.
|
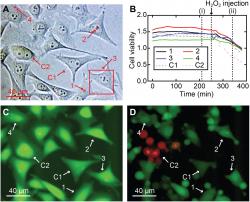
Zobrazení buněk pomocí 3D nanoendoskopie-AFM. (A) Různé měřené oblasti provedené v buněčné kultuře HeLa pro test životaschopnosti buněk, včetně jader a okrajových oblastí buněk: (1) 2 × 2 × 7 μm3, (2) 2 × 2 × 10 μm3, (3) 40 × 40 × 8 μm3 a (4) 2 × 2 × 7 μm3, zvýrazněno červenými čtverečky; dvě buňky byly použity jako kontrola, C1 a C2. (B) Poměry životaschopnosti buněk v průběhu času pro čtyři zobrazené buňky (1 až 4) a pro dvě buňky použité jako kontrola (C1 a C2), což ukazuje, že všechny buňky (zobrazené a kontrolní) vykázaly podobnou intenzitu životaschopnosti - potvrzení, že buňky nebyly příliš poškozeny. (C) Příklad fluorescenčního snímku po 210 minutách. V (B) silná zelená barva znamená normální esterázovou aktivitu očekávanou pro živou buňku. Ke kontrole platnosti testu, byl po 260 minutách do média přidán peroxid, aby buňky zahubil. (D) Fluorescenční snímek odpovídá času (ii) v (B), kde jsou známky poškození jasně viditelné ve všech buňkách, z nichž většina již prodělala smrštění nebo apoptózu. Kredit: Science Advances , 10.1126/sciadv.abj4990
|
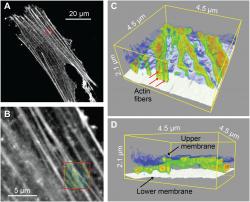
Kombinace konfokálního zobrazování a 3D nanoendoskopie-AFM. (A) Konfokální fluorescenční snímek, na kterém jsou vidět obarvená aktinová vlákna. Aktinová vlákna jsou proteinová vlákna odpovědná za udržování tvaru a vnitřní organizace buňky a udržení vnitrobuněčného transportu. (B) Zvětšený obraz získaný v oblasti označené červeným čtvercem v bodě (A). (C a D) 3D nanoendoskopie-AFM mapy aktinových vláken cytoskeletu získané v oblasti označené červeným čtvercem v (B), kde jsou současně rozlišeny vertikální polohy Z různých aktinových vláken (červené šipky) a horní a dolní buněčné membrány. Poloprůhledný obraz zobrazený červeným čtvercem v (B) odpovídá 2D projekci 3D map zobrazených v (C) a (D). Kredit: Science Advances, 10.1126/sciadv.abj4990
|
Literatura
Jiagui Li, Beatrice Claudi, Joseph Fanous, Natalia Chicherova, Francesca Romana Cianfanelli, Robert A. A. Campbell, Dirk Bumann: Tissue compartmentalization enables Salmonella persistence during chemotherapy. PNAS, published online 13 December 2021.
MARCOS PENEDO, et al.: Visualizing intracellular nanostructures of living cells by nanoendoscopy-AFM, SCIENCE ADVANCES • 22 Dec 2021 • Vol 7, Issue 52 • DOI: 10.1126/sciadv.abj4990
Niels de Jonge, Frances M. Ross.: Electron microscopy of specimens in liquid, Nature Nanotechnology 6, 695–704 (2011)