Alzheimerova nemoc
Kdo by někdy neslyšel o tom „Němci, který nám schovává věci po bytě“? Ovšem každá zapomnětlivost, ani každá stařecká demence, nemusí být rovnou Alzheimer.
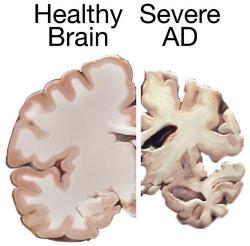
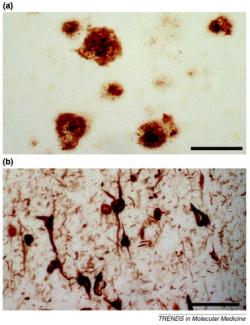
Většina definic Alzheimerovy nemoci začíná tam, kde pacienti bohužel obvykle končí, totiž na patologii. Mozek jejích obětí totiž vykazuje velmi charakteristické změny. Především je nápadně scvrklý. Když se na něj podíváme pod mikroskopem, v prostorech mezi buňkami nacházíme velké množství shluků, které „starým mistrům“ připomínaly škrobovité usazeniny. Zaužívaný termín „amyloidní plaky“ zůstal, ačkoli dnes už víme, že o žádný škrob nejde. Lví podíl na nich má protein, respektive malý „ústřižek“ proteinu, nazvaný amyloid beta. A není to jediná změna. Mikroglie (to jsou takoví mozkoví policajti a metaři) mají nejvyšší pohotovost, v mozku nalézáme stopy zánětu (což je známka obranné reakce), a spoustu odumírajících neuronů či jejich výběžků. Další neurony už ani nenajdeme, a místa jejich posledního odpočinku značí jen takzvaná neurofibrilární klubka, což jsou shluky dalšího proteinu, označovaného řeckým písmenem tau.
Degenerace mozku ale neprobíhá úplně náhodně. Někdy může začít v čichových oblastech (ztráta čichu tak může být předzvěstí ztrát dalších), ale zpravidla ji rozpoznáme tehdy, když zasáhne oblasti spánkových laloků, především hipokampus (strukturu připomínající mořského koníka, odtud i její pojmenování) a sousední oblasti mozkové kůry. Hipokampus a jeho okolí nám umožňuje vyznat se v čase a v prostoru – je důležitý pro prostorovou orientaci a paměť, ale také pro tvorbu ostatních vzpomínek. Právě proto nemocní začínají bloudit a beznadějně se ztrácejí – zprvu třeba při houbaření v lese, později cestou ze samoobsluhy, a nakonec i ve vlastním bytě. A podobně se ztrácejí i ve vlastním životě, když přicházejí o schopnost pamatovat si události a jejich rozmístění v čase (tzv. epizodickou paměť). Poškození ale dříve či později zasáhne i ostatní oblasti mozku, a s nimi funkce, za které jsou zodpovědné. Alzheimerova nemoc tak doslova vymaže pacientovu osobnost mnohem dříve, než jeho trápení ukončí smrt tělesné schránky.
Občas se setkáme s romantizující představou stařečka, který si šťastně žije ve vlastní realitě, kde ho nic netrápí, a málem bychom mu jeho osud mohli i závidět, protože „má všechno, na co si vzpomene“. Jestli někomu chcete závidět Alzheimera, tak na to radši zapomeňte. To, že si nepamatujete, jakou nemoc vlastně máte, totiž neznamená, že jste v pohodě! Pacienti často vědí či tuší, že je s nimi něco v nepořádku, a jsou z toho pochopitelně nešťastní (slovy lékařské vědy: častou komorbiditou Alzheimerovy nemoci jsou deprese a úzkostné poruchy). Vžijte se do situace, kdy se probudíte v úplně cizím bytě, v úplně cizí posteli, obklopeni lidmi, které vůbec nepoznáváte, ačkoli se drze prohlašují za vaše nejbližší. Co byste udělali? Byli byste zmatení? Nešťastní? Pokusili byste se o útěk? Zkusili byste si zjednat pořádek násilím? Tušíte správně, nějak takhle reagují i pacienti s Alzheimerovou nemocí. I pro pečující osoby je psychicky devastující starat se o člověka, který je nepoznává, často s nimi vůbec nespolupracuje, a vyžaduje celodenní (i celonoční) dohled. V pokročilejším stádiu choroby pak nemoc člověka úplně připraví o jeho lidství, stává se zcela nesamostatným a neschopným komunikovat. Péče o pacienta, ať už v domácím nebo institucionálním prostředí, se často stává nekonečným čekáním na milosrdnou smrt. Sečteno a podtrženo, Alzheimerova nemoc je peklem nejen pro samotného pacienta, ale snad ještě více pro jeho okolí.
A je to vůbec nemoc?
Pojem „nemoc“ je neobyčejně fluidní. Co bylo včera charakterovou vadou, je dnes nemocí, co bylo včera nemocí, je dnes respektovanou součástí normy, případně zase naopak.
Do 70. let 20. století převládal pohled, že stařecká demence zkrátka ke stáří patří, a netřeba ji dále pojmenovávat, diagnostikovat nebo vůbec řešit. Mladý dospělý Alzheimerovu nemoc nedostane, i kdyby se rozkrájel; pokud si ovšem počká na své devadesáté narozeniny, má už šanci zhruba padesát na padesát. Pokud nás dříve nezabije něco jiného, dožijeme se demence všichni (jenom záleží, zda to bude zrovna Alzheimer, nebo některá z méně častých, ale podobně ošklivých demencí, případně jejich libovolná kombinace). V novější době se ovšem demence chápe jako něco, co do mozku nepatří, bez ohledu na jeho věk, a měli bychom se snažit tomu předcházet.

Je to tedy nemoc, nebo prostě „jenom stáří“? Zřejmě záleží na úhlu pohledu. Kompromisem budiž výrok, že jde o patologické stárnutí, které přichází dříve a razantněji, než je obvyklé či nutné. Stejně je to u celé řady dalších chronických onemocnění typických pro osoby pokročilého věku. I zde má pochopitelně smysl snažit se jim předcházet a snažit se prodlužovat dobu smysluplně prožitého života na úkor doby, která je pro pacienta i jeho blízké utrpením.
Objevitel(é) Alzheimerovy nemoci
Alzheimerovu nemoc objevil… nějaký Alzheimer – to dá přece rozum! Jenže tak jednoduché to není. Počátkem 20. století zkoumali tuto chorobu hned dva výborní neuropatologové a psychiatři. Vedle Aloise Alzheimera v Mnichově to byl i Oskar Fischer působící na německé universitě v Praze. Oba své výsledky uveřejnili v roce 1907. Ale když dva dělají totéž, není to vždy totéž.
Alzheimer popsal především kazuistiku jedné konkrétní pacientky, Auguste Deter, a neměl ani ambice tvrdit, že objevil „novou nemoc“. Do dějin vstoupil Alois Alzheimer především díky svému vedoucímu, Emilu Kraepelinovi, který byl autorem vlivné klasifikace duševních poruch, v níž neopomněl zvěčnit jméno svého asistenta. Zajímavé je, že Kraepelin Alzheimerovu nemoc definoval jako předčasný výskyt změn, které se obvykle objevují až v pokročilém stáří, ale zde již v páté dekádě života. Řečeno moderní terminologií, popsal Alzheimerovu chorobu s časným nástupem, což je obávaná, avšak naštěstí velmi vzácná forma této nemoci (jak ji chápeme dnes). K rozšíření definice i na případy demence v pokročilejším věku došlo až mnohem později a sám Kraepelin by s tím jistě důrazně nesouhlasil.
Fischer naopak studoval mnohem obvyklejší neurodegenerativní změny ve vyšším věku, a to na rozsáhlejším souboru pacientů. Obvyklejší formu Alzheimerovy choroby s pozdním nástupem tedy popsal Oskar Fischer. Přesto obě formy nesou jméno jen prvně jmenovaného. Můžeme s tím nesouhlasit, můžeme o tom vést spory, ale to je asi tak všechno, co se proti tomu dá dělat. Na rozdíl od Alzheimera neměl Oskar Fischer nikoho, kdo by jeho práci zajistil nesmrtelnost. Jakožto Žid skončil za 2. světové války v terezínském ghettu, kde také zemřel, a k jeho myšlenkovému odkazu se pak nehlásili ani Němci, pro které byl Židem, ani Češi, pro které byl Němcem. Jeho práce byla na dlouho zapomenuta a znovuobjevena až v novém tisíciletí.

Prevence a léčba
Cynik by řekl, že nejlepší prevencí Alzheimerovy nemoci je zemřít mladý a měl by hlubokou pravdu. Statistik by dodal, že riziko může ovlivnit také vzdělání nebo zdravá životospráva doplněná pravidelným tréninkem těla i ducha. Ale ruku na srdce, spoléhat se na to nedá.
S léčbou je to ještě horší. Některé obtíže pacientů lze s pomocí léků zmírnit nebo krátkodobě povzbudit jejich paměť, na postupné chátrání mozku to však podle všeho nemá vůbec žádný vliv. Mnoho úsilí i peněz padlo na vývoj léků zamířených na amyloid beta. Cílem je zablokovat jeho tvorbu, nebo jej z mozku odstranit. Na myších to funguje. Ale co u lidí? Dobrá zpráva: amyloidu ubývá. Špatná zpráva: ničemu to příliš nepomáhá, občas to dokonce uškodí. Z této kategorie je i lék aducanumab (Aduhelm) nedávno schválený ke klinickému užití v USA, jehož účinnost i bezpečnost jsou předmětem značných kontroverzí. „Na cestě“ jsou další medikamenty, slibně postupuje například ALZ-801 (valiltramiprosate) vyvíjený americkou firmou s českou stopou, zvanou Alzheon. Kde však tato cesta skončí, může ukázat jedině čas a klinické studie.
Alzheimerova nemoc je skutečným hřbitovem klinických studií. Jen mezi lety 2002 – 2012 se uskutečnilo 413 klinických studií léků na Alzheimerovu nemoc, aniž by se objevil jediný, který by přinesl alespoň dílčí průlom. Následující dekáda se z tohoto trendu také nevymkla. Je to docela tristní, zvlášť když uvážíme, jak je taková klinická studie drahá (řádově desítky milionů dolarů). Pochopitelně se léky klinicky netestují nazdařbůh, ale jen tehdy, jsou-li dobré důvody věřit, že by mohly skutečně pomoci – ve zkumavce nebo u laboratorní myši „něco dělají“. O to je výsledné zklamání větší – a ochota farma firem investovat do dalšího podobného pokusu menší.
Příčiny Alzheimerovy nemoci
Kdyby to nebyla tak vážná věc, mohli bychom se nad tím dobře bavit. Vědecká obec se rozštěpila na dva nesmiřitelné tábory, přesně podle dvou proteinů, které se v mozku nemocných hromadí. „Betisté“ tvrdí, že příčinou Alzheimerovy nemoci je hromadění amyloidu beta v mozku – amyloid je ústředním padouchem, strůjcem a hybatelem všeho ostatního. Naopak „tauisté“ tvrdí, že kořenem zla je hromadění nadměrně fosforylovaného proteinu tau, a vše ostatní – včetně produkce amyloidu – je jen důsledkem.

Na straně „betistů“ stojí jediná dosud jasně identifikovaná příčina Alzheimerovy nemoci: genové mutace, které zvyšují produkci amyloidu beta (jde o změny v genech pro amyloidní prekurzorový protein, z něhož se amyloid beta odštěpuje, a presenilin, který tomuto štěpení dopomáhá). Ty vedou k takzvané familiální formě Alzheimerovy nemoci – je to typické rodové prokletí táhnoucí se z generace na generaci (pěkně podle Mendela), navíc charakteristické časným nástupem demence (vzpomínáte na výše zmiňovanou Alzheimerovu chorobu s časným nástupem?). Tedy přesně to, o čem psali Alzheimer s Kraepelinem. Když nějakou takovou mutaci (nebo ještě lépe více mutací) přivodíme laboratorní myši nebo potkanovi, začnou se ztrácet v bludištích, jejich mozky začnou degenerovat a objeví se v nich amyloidní plaky. Jasný případ? Ne tak rychle. Více než 95 % pacientů s Alzheimerovou nemocí totiž takovouto mutaci vůbec nemá, a nemoc se na ně snese jakoby „z čistého nebe“ – hovoříme o tzv. sporadické formě Alzheimerovy nemoci, které bychom mohli klidně říkat třeba „Fischerova nemoc“ (to je ta zmiňovaná Alzheimerova nemoc s pozdním nástupem). O příčinách rozvoje nemoci u těchto pacientů nevíme zhola nic.
Správný „tauista“ by neopomněl podotknout, že na příběhu s amyloidem něco nehraje. Občas najdeme pacienty, kteří mají v mozku nemalé množství plaků (díky moderní technice to dokonce můžeme zjistit i dříve než v pitevně!) ale přitom nejsou ani trochu dementní. Množství shluklého proteinu tau s mírou zblbělosti souhlasí o něco lépe.
Kyvadlo dějin se dlouho přiklánělo spíše k „betistům“. Řada medikamentů cílila na amyloid, nebo se snažila mozek před ním ochránit, a byla (úspěšně) otestována na transgenních hlodavcích s amyloidními plaky. Všechno vypadalo krásně a idylicky, dokud do toho nehodili vidle ti oškliví klinici, že prý to pacientům vůbec nepomáhá, nebo dokonce škodí! A jak jsme si řekli, tohle se nestalo jednou, dvakrát, a dokonce ani desetkrát...
Považovat patologické shlukování proteinů za příčinu Alzheimerovy nemoci je možná podobně pomýlené, jako považovat vysoký krevní tlak za příčinu hypertenze nebo zvýšený krevní cukr za příčinu diabetu. Jistě, jsou to diagnostická kritéria, ale skutečné příčiny musíme hledat jinde.
Alzheimerova nemoc jako důsledek infekce?
Už Alzheimer s Fischerem něco tušili. Oba měli bohaté zkušenosti s jiným, v jejich době mnohem četnějším degenerativním onemocněním mozku: neurosyfilidou, jejíž původce (Treponema pallidum) byl tehdy čerstvě popsán. Také zde vidíme aktivované mikroglie, zánět, odumírání neuronů, ale dokonce i hromadění tau a amyloidu. Domněnka, že i u Alzheimerovy nemoci by mohla být příčinou infekce, byla tedy nasnadě. Identifikace původce, to už byl ovšem mnohem složitější oříšek, který se v 19. ani ve 20. století rozlousknout nepodařilo. Ještě zcela nedávno, v r. 2019, vypsal americký lékař Dr. Leslie Norrins peněžitou odměnu ve výši jednoho milionu dolarů za nalezení mikroba vyvolávajícího Alzheimerovu nemoc. Jak asi tušíte, marně. Není to ale tak, že by chyběli kandidáti. Naopak. Údajných původců se totiž vyrojilo až moc!
V mozcích pacientů s Alzheimerovou nemocí byla v různých studiích během posledních 40 let identifikována celá mikrobiální zoo. Například spirochety – bakterie šroubovicového tvaru, mezi nimi Borrelia burgdorferi (původce Lymeské boreliózy) ale i její příbuzné z rodu Treponema, a to konkrétně druhy známé jako původci parodontózy. Také další bakterie libující si v zanícených dásních, Porphyromonas gingivalis, si našla cestu do alzheimerických mozků. Ve vybrané společnosti nemohly chybět ani chlamydie, a také Propionibacterium acnes, která jinak komplikuje život spíše pubescentům. Zahanbit se nedaly ani viry ze skupiny herpesvirů, v čele s HSV1 (herpes simplex virus, původce oparu) a jeho příbuznými HHV6 a HHV7 (human herpes virus, původci tzv. „šesté dětské nemoci“), VZV (varicella zoster, původce pásového oparu) a cytomegalovirem. A konečně byly ve scvrklých mozcích pacientů identifikovány i houbové infekce (např. kandidózy).
Přítomnost mikroba v mozku senilního pacienta ale ještě neznamená, že byl příčinou rozvoje demence. Může jít o „náhodné kolemjdoucí“, kteří se vetřeli do mozku smrtelně nemocných pacientů v důsledku jejich podlomené imunity – možná byli tou poslední kapkou, ale jistě ne prvotní příčinou. Mikroorganismy se též mohou dostat do mozku až po smrti pacienta (živým pacientům mozek odebírati neradno), nebo kontaminovat vzorky při odběru nebo později v laboratoři. Všechna podobná pozorování je tedy třeba brát s velkou mírou opatrnosti.
Co vlastně ten amyloid dělá?
Amyloid beta rozhodně není žádné neviňátko. Je to peptid (ústřižek proteinu), který má tendenci lepit se na sobě podobné (agregovat). Vznikají tak zprvu menší oligomery (slepené jen z několika těchto peptidů; z řeckého oligos, málo), a později plaky tak velké, že jsou vidět i v obyčejném mikroskopu. Tyto agregáty mohou narušovat funkci synapsí (nervových spojů), provokovat zánětlivé reakce, a dokonce působit oxidativní poškození volnými radikály, což v konečném důsledku devastuje mozkovou tkáň.
Jenže pokud je amyloid beta ryzí padouch, proč ho vůbec náš mozek vytváří? A co je možná ještě zásadnější, proč ho vytváří i většina ostatních živočichů včetně bezobratlých? Konkrétně v evoluci savců se amyloid beta měnil jen velice málo a nikde úplně nevymizel. Pokud příroda něco takhle úzkostlivě udržuje, většinou dobře ví, co dělá. A že by byla až tak zlomyslná, aby nám do mozku schválně nainstalovala „kazítko“, se člověku věřit nechce.
Co tedy dělá amyloid beta, pokud zrovna nezpůsobuje Alzheimera? Klást si tuhle otázku se v některých kruzích, kdoví proč, donedávna považovalo za bezmála neslušné. Navržených možností je přesto nepřeberná spousta a některé se ani nemusí navzájem vylučovat. Není zde však prostor k tomu, abychom se všemi důkladně zabývali, takže jen stručně: Amyloid beta podle různých studií „něco dělá“ okolo synapsí, ale taky pomáhá mozku zotavit se po zranění, utěsňuje trhliny v hematoencefalické bariéře (ta odděluje mozek od krve a brání průniku nežádoucích molekul nebo buněk) a brání růstu nádorů. Kromě toho taky vyvazuje ionty kovů, jako je železo, měď nebo hliník. A konečně, amyloid beta se ukazuje jako efektivní zabiják. A to především zabiják bakterií, virů a kvasinek.
Amyloid jako obránce

Hypotézu antimikrobního působení amyloidu beta zformuloval nedávno zesnulý Robert D. Moir (1). Obávaný amyloid je podle ní součástí nespecifického imunitního systému, a společně s mikrogliemi pomáhá chránit mozek před nezvanými hosty. Amyloid beta ovšem není svým výskytem nikterak vázán na centrální nervový systém, a skutečný rozsah i význam jeho činnosti v organismu jako celku zatím sotva tušíme.
Amyloid se patrně váže na cizorodé objekty, jako jsou virové částice nebo nepřátelské buňky, a díky své schopnosti agregovat je obalí a uvězní ve svých shlucích. Vetřelci jsou tak znehybněni, a nemohou dále provádět své nekalé rejdy. Navázaný amyloid navíc okamžitě přivolá mikroglie, které nejprve spustí chemický poplach v podobě interferonů a cytokinů, a posléze uvězněné nepřátele snadno sežerou (fagocytují) nebo zahubí chemicky. Amyloid navíc může přímo zabíjet bakterie. Podle některých autorů vytváří póry v jejich membránách, a tak z nich udělá doslova řešeto.
Docela nedávno se ukázalo, že podobné antimikrobní působení má také alfa-synuklein, peptid, který se patologicky hromadí u dalších forem demence, například Parkinsonovy nemoci (2).
Bojiště mozek
Kdo je tedy úhlavním nepřítelem v našem mozku, proti němuž povoláváme amyloid beta? Rozhodně není jen jeden! Proto také neuspěly snahy nalézt konkrétního „původce Alzheimerovy nemoci“, a různé studie opakovaně nacházely či zase nenacházely v nemocných mozcích toho či onoho mikroba. Dnes už jsme ale dál, a několik studií ukázalo celý řetězec příčin a následků.
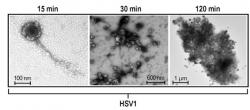
Řada badatelů se soustředila na herpesviry. Jejich zapojení dává dobrý smysl, zdaleka to totiž nejsou jen původci nepříjemných, ale neškodných oparů. Ochotně napadají nervovou soustavu, jsou schopny v ní dlouhodobě nenápadně přežívat – nějaký ten herpesvirus v sobě nosíme skoro všichni – a vyčkávají na jakékoli oslabení hostitele, aby se aktivizovaly a začaly nám opět škodit. Roli herpetických virů zkoumal mezi jinými Matthew A. Wozniak z university v Manchesteru, který zjistil, že u izolovaných mozkových buněk nebo v mozcích pokusných myší spouští přítomnost virových partikulí tvorbu amyloidu beta a fosforylaci proteinu tau (3,4). Amyloid pak útočí na virové částice, váže se na ně a nakonec je uvězní. Transgenní myši produkující zvýšené množství amyloidu beta sice ke stáru trpí demencí, ale zase mají dobrou šanci přežít infekci jinak smrtelnou dávkou viru HSV1 (5). Nově byla tato pozorování ověřená na mozkových organoidech, což jsou miniaturní „mozky“ vypěstované takříkajíc ve zkumavce z kmenových buněk. Dana M. Cairnsová z Tuftsovy university v Medfordu zjistila, že herpetická infekce v „minimozku“ odstartuje všechny změny, které nalézáme u senilních pacientů: tvorbu amyloidu beta a jeho shlukování do plaků, hyperfosforylovaný protein tau, zánětlivé změny, aktivaci mikroglií a nakonec i odumírání neuronů (6). Tyto práce také naznačují možný směr léčby: tlumení virové infekce a zánětlivé reakce. Právě probíhají klinické studie antivirotik (valacyclovir, apovir) u pacientů s Alzheimerovou nemocí.
To ale neznamená, že ostatní podezřelí by se nechali zahanbit.
Pacienti s Alzheimerovou nemocí často trpí záněty dásní, a bakterie nebo jejich toxiny mohou z ústní dutiny proniknout až do mozkové tkáně. Stephen S. Dominy a mezinárodní kolektiv (7) nedávno ukázali, že běžná ústní bakterie Porphyromonas gingivalis, pokud ji aplikujeme do tlamiček laboratorních myší, proniká do mozku a zvyšuje tam produkci amyloidu. Navíc uvolňuje toxiny, které zabíjejí neurony a poškozují protein tau. Podobně může působit i Chlamydia pneumoniae, původce úporných zápalů plic, ale i vaskulárních infekcí. U myší snadno proniká skrze nosní sliznici a čichový nerv do mozku, kde vyvolá zánět, produkci amyloidu beta a nakonec i amyloidních plaků (8). U myší přitom amyloidní plaky přirozeně nevznikají.
Yifan Wu a jeho kolegové z Houstonu (9) experimentálně nakazili myši patogenní kvasinkou Candida albicans. Zjistili, že je schopna dostat se z krve až do mozku (skrze hematoencefalickou bariéru, která normálně mozek ochraňuje) a dělá tam neplechu: spustí zánět a aktivuje mikroglie, a v místě infekce vzniká amyloidní prekurzorový protein i samotný amyloid beta. Na zničení kvasinky sice amyloid sám nestačí, ale označí cíl pro dělostřelectvo v podobě mikroglií, a ty už si s ní poradí: buď ji pohltí (fagocytují) nebo otráví fungicidními výměšky. Myši, kterým genoví inženýři odstranili gen pro amyloidní prekurzorový protein, se kvasinkové infekce zbavovaly hůře než myši normální. Ve výhodě naopak byly transgenní myši, které amyloidu tvořily nadbytek.
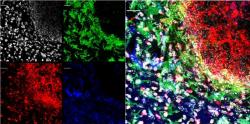
Amyloid a jeho shlukování se tedy jeví jako přirozená a funkční odpověď na průnik mikrobů do mozku. Jako v každé bitvě jsou i nějaké ty civilní oběti, v tomto případě neurony, ale volně pobíhající mikrobi by v mozku napáchali škody mnohem víc.
Alzheimerova choroba jako poslední vzdor
Mladý mozek je dobře chráněnou pevností. Sotvakdy do něj někdo z vnějšku pronikne, a pokud ano, je bez milosti zlikvidován. Na druhé straně je ale schopen své zabijáky držet na uzdě a vrátit se zase do mírového stavu. Po infekci se může amyloidu úplně zbavit, například prostřednictvím mikroglií, které jej fagocytují, nebo jej odplavit ve spánku tzv. glymfatickým systémem. Případně v místě infekce zůstane nějaký ten amyloidní plak jako neškodný pomníček vítězného boje – to jsou možná ony případy, kdy v mozku vidíme plaky, ale „pacient“ je zcela zdráv.
Jenže ke stáru už tělo není, co bývalo, a týká se to i jeho obranných mechanismů. Bariéry dělící střevní obsah od krevního oběhu, nebo krev od mozku, začínají být prostupné, a armáda imunitního systému začíná připomínat spíše spolek vysloužilců. S patogeny si pořádně neporadí, ale zato dobře umí vleklé zánětlivé reakce, které zpravidla nadělají víc škody, než užitku. Slábnoucí organismus čelí stále silnějšímu náporu mikroskopických útočníků, a je jen otázkou času, kdy některý pronikne až do té nejlépe chráněné citadely – mozku. Může se tam dostat podél nervů (např. čichového) nebo přímo z krevního oběhu. Nezáleží na tom, který konkrétní mikrob to bude. Rozhoduje jeho schopnost vyvolat tam vleklou infekci, kterou organismus není s to zlikvidovat. Může dokonce dojít ke vzpouře spících agentů, po dlouhá léta držených na uzdě imunitním systémem, jako jsou herpesviry nebo endogenní retroviry.
Mozek se pochopitelně brání všemi prostředky, které má k dispozici: jsou povolány mikroglie, vzniká zánět, a z buněk je ve velkém vypouštěn amyloid beta. Až zlověstně to připomíná boj v ulicích velkoměsta: ztráty obrovské, naděje na úplné rozdrcení nepřítele mizivé, zato postranní škody nevyčíslitelné. V troskách se hemží zabijáci – aktivované mikroglie a molekuly amyloidu – kteří se dávno vymkli kontrole, zabíjejí neurony, které původně měli chránit. Je možné, že v některých případech lidské tělo dosáhne svého Pyrrhova vítězství a infekce se zbaví, jenže nerozpustné amyloidní plaky zůstávají a dál vyvolávají zánětlivou reakci okolních buněk. Zánět a stárnutí jdou ruku v ruce, dokonce natolik, že si v odborné literatuře vysloužily společný termín: inflammaging. Válka v mozku zuří dál. Až nakonec není o co bojovat: organismus umírá.
Zlověstné souvislosti
Alzheimerova nemoc a infekce, to patří k sobě. Riziko Alzheimerovy nemoci je větší u pacientů s chronickými záněty, včetně zánětů dásní (10). Zanedbaná zubní hygiena nás tak na stará kolena může připravit nejen o zuby, ale i o vzpomínky. A když byla řeč o respiračních infekcích, ty jsou jednou z nejčastějších příčin smrti osob s demencí, a možná to není úplná náhoda.
Vzhledem k tomu, že většina „původců Alzheimera“ je v podstatě všudypřítomná, nemělo by smysl panikařit a dědečky a babičky s demencí izolovat jako malomocné. Je ale pravda, že zvýšená expozice těmto mikrobům zřejmě nebude dvakrát zdravá. Statisticky tak bylo zjištěno, že osoby pečující o partnera s Alzheimerovou nemocí a sdílející s ním domácnost mají šestinásobně vyšší šancí, že Alzheimerovou nemocí samy onemocní, a to i při odečtení všech známých rizikových faktorů genetiky a prostředí. Autoři výzkumu přitom možnost infekce vůbec neuvažovali, předpokládali, že spouštěčem je psychický stres (11). Podobně zvýšené riziko Alzheimerovy nemoci vykazují i neurochirurgové, u nichž je předpoklad, že mohou být vystaveni infikované mozkové tkáni. U lékařů jiných specializací se žádné zvýšené riziko nepozoruje (12).
Pro úplnost je třeba podotknout, že i samotné patologické proteiny tau a amyloid beta by se mohly chovat jako priony, a být tedy infekčními činiteli (viz také zde). Tato zajímavá a poněkud strašidelná možnost by ovšem vydala na samostatný článek, a proto ji zde zmiňujeme jen pro úplnost.
Co z toho plyne?
Pokud je infekční hypotéza Alzheimerovy nemoci platná, co z toho plyne pro její léčbu? Anti-amyloidní terapie by bez dalších opatření měla podobný efekt, jako kdybychom obráncům obleženého města sebrali zbraně. Skutečně, odstranění amyloidu beta z mozku v klinických studiích pacientům spíše uškodilo a potýkali se i se zvýšeným rizikem infekčních chorob. Abychom mozek uzdravili, musíme jej především zbavit infekce. To se snadněji řekne, než udělá. Spouštějících mikrobů je zřejmě celá řada, a s každým je potřeba bojovat jinak. A jestli mají patogeny spojované s Alzheimerem něco společného, je to houževnatost: dají se zahnat do zákopů, ale jen stěží zcela zničit. Teprve kdybychom uspěli, mohli bychom pacientům dále pomoci protizánětlivou léčbou a odstraněním amyloidu beta z mozku, abychom ukončili zničující válku. Léčba pochopitelně musí nastoupit včas, ještě předtím, než je mozek nenávratně poškozen.
Lepší perspektivu snad bude mít prevence: podpora imunitního systému, důsledné potírání vleklých infekcí, vývoj vakcín, antibiotik a antivirotik proti podezřelým patogenům, a v neposlední řadě i důraz na ústní hygienu.
Závěr
Infekční hypotéza Alzheimerovy nemoci stále leží daleko mimo mainstream. Třebaže je tu s námi v podstatě od samotného objevu Alzheimerovy nemoci a opakovaně se vynořovala v posledních čtyřiceti letech, dlouhá léta byla nejen ignorována, ale vysloveně potlačována vědeckým establishmentem. Tato dlouhodobá neochota vědců, institucí i odborných periodik zabývat se příčinami Alzheimerovy nemoci bude jednou zajímavým námětem ke studiu pro historiky a filosofy vědy.
Během posledních několika let se ovšem ledy poněkud hnuly, a publikace hledající příčiny Alzheimerovy nemoci a fyziologické funkce amyloidu beta se začaly rojit jako houby po dešti. Zatím je předčasné tvrdit, že je infekční hypotéza potvrzena, rozhodně si však zasluhuje seriózní pozornost, stejně jako všechny její alternativy. Byli bychom rádi, kdyby se nám podařilo k tomuto úsilí vlastním dílkem přispět.
Poděkování
Chtěli bychom zde poděkovat především Dr. Zdeně Krištofikové, která nás k této problematice přivedla.
Literatura
-
Moir, R. D., Lathe, R., & Tanzi, R. E. (2018). The antimicrobial protection hypothesis of Alzheimer’s disease. Alzheimer’s & Dementia, 14(12), 1602–1614. https://doi.org/10.1016/j.jalz.2018.06.3040
-
Alam, Q., Zubair Alam, M., Mushtaq, G., A. Damanhouri, G., Rasool, M., Amjad Kamal, M., & Haque, A. (2016). Inflammatory process in Alzheimer’s and Parkinson’s diseases: Central role of cytokines. Current Pharmaceutical Design, 22(5), 541–548. https://doi.org/10.2174/1381612822666151125000300
-
Wozniak, M. A., Itzhaki, R. F., Shipley, S. J., & Dobson, C. B. (2007). Herpes simplex virus infection causes cellular β-amyloid accumulation and secretase upregulation. Neuroscience Letters, 429(2–3), 95–100. https://doi.org/10.1016/j.neulet.2007.09.077
-
Wozniak, M. A., Frost, A. L., & Itzhaki, R. F. (2009a). Alzheimer’s disease-specific tau phosphorylation is induced by herpes simplex virus type 1. Journal of Alzheimer’s Disease, 16(2), 341–350. https://doi.org/10.3233/JAD-2009-0963
-
Eimer, W. A., Vijaya Kumar, D. K., Navalpur Shanmugam, N. K., Rodriguez, A. S., Mitchell, T., Washicosky, K. J., György, B., Breakefield, X. O., Tanzi, R. E., & Moir, R. D. (2018). Alzheimer’s disease-associated β-amyloid is rapidly seeded by herpesviridae to protect against brain infection. Neuron, 99(1), 56-63.e3. https://doi.org/10.1016/j.neuron.2018.06.030
-
Cairns, D. M., Rouleau, N., Parker, R. N., Walsh, K. G., Gehrke, L., & Kaplan, D. L. (2020). A 3D human brain–like tissue model of herpes-induced Alzheimer’s disease. Science advances, 6(19), eaay8828.
-
Dominy, S. S., Lynch, C., Ermini, F., Benedyk, M., Marczyk, A., Konradi, A., Nguyen, M., Haditsch, U., Raha, D., Griffin, C., Holsinger, L. J., Arastu-Kapur, S., Kaba, S., Lee, A., Ryder, M. I., Potempa, B., Mydel, P., Hellvard, A., Adamowicz, K., … Potempa, J. (2019). Porphyromonas gingivalis in Alzheimer’s disease brains: Evidence for disease causation and treatment with small-molecule inhibitors. Science Advances, 5(1), eaau3333. https://doi.org/10.1126/sciadv.aau3333
-
Balin, B. J., Hammond, C. J., Little, C. S., Hingley, S. T., Al-Atrache, Z., Appelt, D. M., Whittum-Hudson, J. A., & Hudson, A. P. (2018). Chlamydia pneumoniae: An etiologic agent for late-onset dementia. Frontiers in Aging Neuroscience, 10, 302. https://doi.org/10.3389/fnagi.2018.00302
-
Wu, Y., Du, S., Johnson, J. L., Tung, H.-Y., Landers, C. T., Liu, Y., Seman, B. G., Wheeler, R. T., Costa-Mattioli, M., Kheradmand, F., Zheng, H., & Corry, D. B. (2019). Microglia and amyloid precursor protein coordinate control of transient Candida cerebritis with memory deficits. Nature Communications, 10(1), 58. https://doi.org/10.1038/s41467-018-07991-4
-
Leira, Y., Domínguez, C., Seoane, J., Seoane-Romero, J., Pías-Peleteiro, J.M., Takkouche, B., Blanco, J., Aldrey, J.M., 2017. Is periodontal disease associated with Alzheimer’s disease? A systematic review with meta-analysis. Neuroepidemiology 48, 21–31. https://doi.org/10.1159/000458411
-
Norton, M. C., Smith, K. R., Østbye, T., Tschanz, J. T., Corcoran, C., Schwartz, S., ... & Cache County Investigators. (2010). Greater Risk of Dementia When Spouse Has Dementia? The Cache County Study. Journal of the American Geriatrics Society, 58(5), 895-900.
-
Lollis, S. S., Valdes, P. A., Li, Z., Ball, P. A., & Roberts, D. W. (2010). Cause-specific mortality among neurosurgeons. Journal of neurosurgery, 113(3), 474-478.