Masivní, kompaktní nádory (solid tumors) vytvářejí ohraničené abnormální tkáňové útvary. Jak rostou, obklopují se těžko proniknutelnou molekulární barikádou. Není to jen tak, přes ní propašovat léky. Vědcům z Jihozápadního lékařského centra Texaské univerzity v Dallasu (University of Texas Southwestern Medical Center) se podařilo vyvinout lipidové nanočástice, které to svedou. Nejen překonají obranné linie nádoru a doputují až k samotným nekontrolovatelně se dělícím buňkám, ale přes jejich buněčnou stěnu propašují do cytoplasmy důležitý náklad – genetickou „samočinnou“ soupravu naprogramovanou na editaci předem určených genů. Takové genetické manipulace in vivo mohou tlumit růst tumoru i aktivovat imunitní systém.
Vědci, kteří tyto transportní nanočástice popsali ve studii zveřejněné v časopisu Nature Nanotechnology, to dokázali u nádorů vaječníků a jater transgenních myší s cílenou genetickou predispozicí k těmto onkologickým nemocem. Podle hlavního autora studie, Daniela Siegwarta, docenta biochemie na UT Southwestern, jde o velice perspektivní způsob, jak využít genetický nástroj CRISPR-Cas9 v léčbě rakoviny. CRISPR je velice důmyslná metoda genetické editace, jejíž princip jsme před více než deseti lety odkoukali od bakterií. Je to jejich účinná antivirová obrana. To, co evoluce v souboji mezi bakteriemi a viry vyvíjela po stovky milionů let, dokázali vědátoři během krátké doby uzpůsobit a rozvinout do metodiky CRISPR-Cas9, jež umožňuje selektivně upravovat DNA uvnitř živých buněk. Chce to však ještě dořešit efektivní dopravu genetické zásilky do cíle.

Tým Daniela Siegwarta již deset let studuje a navrhuje nové lipidové nanočástice – miniaturní kuličky tukových molekul, které dokážou do buněk určité tkáně živého organismu přenášet náklad molekul léčiva nebo genetické informace v podobě ribonukleové kyseliny. Na tomto principu byly například vyvinuty i mRNA vakcíny proti COVID-19 (Pfizer a Moderna), kde lipidové nanočástice transportovaly mediátorovou RNA – genetický předpis pro syntézu koronavirového spike proteinu.
Vědci z Texaské univerzity se však zaměřili na rakovinu a využili lipidové nanočástice, které již dříve uzpůsobili k dopravě léků do nemocných jater. Nyní ale do tukového mini balíčku vložili kousek takzvané „malé interferující RNA“ (siRNA - small interfering RNA), schopné utlumit expresi klíčového genu pro fokální adhezívní kinázu (FAK) - součást obranného systému buněk některých nádorů.
"Cílení na FAK nejen oslabuje ochrannou barikádu kolem nádorů a usnadňuje samotným nanočásticím se do něho dostat, ale také dláždí cestu pro vstup imunitním buňkám“, vysvětluje první autor článku, postdoktorand Di Zhang, Ph.D.
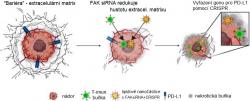
I samotný imunitní systém dokáže eliminovat různě poškozené buňky, tedy i rakovinové. Proti tomu se ale rostoucí kompaktní nádor dokáže bránit nejen málo propustným povrchem, ale i vyšší hladinou proteinu s označením PD-L1. Brzdí aktivitu imunitního systému a zvyšuje agresivitu rakoviny. Vědci proto kromě zmíněné siRNA do nanočástic zapouzdřili i molekulární mechanismus CRISPR-Cas9 naprogramovaný právě ke změně genu pro protein PD-L1 tak, aby ho buňky již neprodukovaly.
První testy nových nanočástic na čtyřech typech modelových myších linií s rakovinou vaječníků a jater dopadly velice nadějně. Přítomná siRNA vypnula gen pro fokální adhezívní kinázu FAK, v důsledku čeho se jinak tuhá obalová vrstva nádorů rozvolnila a stala se tak prostupnější. Do útrob samotného nádoru se pak probojovalo mnohem více dopravních nanočástic, jejichž zásilka v účinné míře pozměnila gen pro protein PD-L1 v buňkách.
V porovnání s myškami v kontrolní skupině, které byly „léčeny“ jen prázdnými nanočásticemi, jejich o něco šťastnějším družkám terapie nanočásticemi s nákladem pro cílenou genetickou manipulaci DNA nádorových buněk prodloužila život na asi dvojnásobek. Jejich nádory se o asi osminu zmenšily a byly osídleny imunitními buňkami.
##seznam_reklama##
I když výsledky jsou povzbudivé, jde o počáteční studii. K potvrzení bezpečnosti a účinnosti nových nanočástic také u dalších typů nádorů povede nejspíš ještě dlouhá cesta. Vědci jsou přesvědčeni, že jejich metoda může výrazně přispět k účinnosti existujících imunoterapeutických postupů při léčbě rakoviny, protože se navzájem podporují. V obou případech je imunitní systém vybuzen k útoku na nádorové buňky.
Video: Úprava genomu pomocí CRISPR-Cas9 Kredit: McGovern Institute
Literatura: Nature Nanotechnology, The University of Texas Southwestern Medical Center
