V odborném časopise Frontiers in microbiology vyšel článek pod názvem „Regulátor transkripce CtrA řídí genovou expresi u fágů Alphaproteobacteria". Normálnímu smrtelníkovi to moc neřekne, a proto pozornost nevzbudil. Přesto si o výsledcích pokusů popsaných v genetické hantýrce něco řekneme. Studie je výsledkem bádání kolektivu z Baltimore, Oxfordu, Texasu a Barcelony vedeným Ivanem Erillemem - světově uznávaným expertem na bakteriofágy. Sám pro ně raději používá kratší název „fágy“. Ve skutečnosti jde o viry. V tomto případě nám od nich žádné nebezpečí nehrozí, jsou úzce specializované a napadají jen bakterie. Poznatek by ale mohl vést k získání nových typů antivirotik pro humánní medicínu, a to je důvod, proč stojí za to se objevu věnovat.
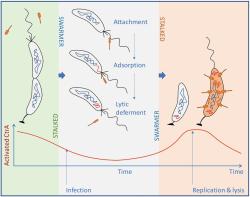
Začalo to tím, že si výzkumníci u fágů povšimli jisté podivnůstky. Že totiž své hostitelky napadají jen někdy. A sice když mají na svém povrchu pili a bičík, což jsou výběžky s jejichž pomocí se bakterie pohybují. Teď malinko odbočíme a zabrousíme do genetiky. Konkrétně do úlohy genu CtrA. To on má na starosti tvorbu proteinu stejného jména a bakterie si jimi řídí ve svém buněčném cyklu celou řadu záležitostí, včetně tvorby oněch zmíněných výběžků (pili a bičíků).
Ještě jednu odbočku teď uděláme. Tentokrát šmírovací do intimního chování bakterií. Smysl nám to vše začne dávat (tak jako vědcům) až ke konci celého příběhu. Když na bakterie (Caulobacter) přijdou rozmnožovací choutky, má na výběr. Buďto dá vznik dvěma stejným buňkám (dělí se symetricky), nebo se rozdělí asymetricky. To se pak od stonkové buňky odděluje pohyblivá rojová buňka. Ta má bičík a plave. Po asi půl až hodině plavby svůj „motor“ odvrhne a přetvoří se do usedlé stonkové buňky. Pomocí adhezivní organely se svou stopkou přichytí nějakého povrchu a je-li prostředí příznivé, cyklus množení se rychle opakuje.
Když se vrátíme k našemu genu a jeho proteinu CtrA – regulačnímu prvku bakteriálního buněčného cyklu (diktujícímu zda dojde k dělení rovnoměrnému na dvě buňky stejného buněčného typu, nebo asymetrickému za vzniku jedné rojové a jedné stonkové buňky), začíná dávat smysl, proč fágy mají vybavení, kterým hladinu CtrA registrují. Umožňuje jim to „odečíst“, kdy jsou (nebo se mu blíží) jejich hostitelky ve stadiu rojové buňky (s bičíkem), tedy ve stadiu, které umí infikovat.
Proč to evoluce zařídila tak složitě?
I na to mají vědci odpověď. Obecně bakterie žijí v prostředí chudém na živiny. Množí se málo a pro viry by nebylo moudré, aby živořící buňku zahubily. Těžko by totiž v okolí hledaly další nešťastnice vhodné k napadení. Když ale nastanou bakteriím dny hojnosti, stopkové buňky se začnou množit za vzniku rojových buněk. Fágům se vyplatí ve svém hostiteli čekat na dobu, kdy s velkou pravděpodobností také sousední bakterie v kolonii se rozhodnou množit asymetricky a kdy výsledkem jsou rojové buňky s bičíkem. Z pohledu sobeckých zájmů virů se vyčkávací strategie odvděčí bohatě prostřeným "stolem" plným rojovek.
Vědci ve studii uvádějí i další poznatky. Například, že DNA vzory (na něž se protein CtrA váže) má nejen jeden druh fága. Dokonce ani ne jen jedna jejich skupina, ale nejspíš všechny fágy, které napadají bakterie obdařené pili a bičíkem. Genomová analýza vědcům odhalila, že tento mechanismus evoluce u různých skupin nitrobuněčných parazitů vybavila vícekrát. To pochopitelně nemůže být náhoda a opravňuje to k následujícímu závěru. Pokud se v evoluci nějaká strategie vyvine nezávisle opakovaně, znamená to, že se osvědčuje a že lze něco podobného (s jiným genetickým vzorem) očekávat i u jiných virů. Slovy Erillovými: „Pokud se něco děje u bakterií, je téměř jisté se to bude dít u rostlin a živočichů“.
##seznam_reklama##
Lidským virům by se podobná optimalizace strategie pro přežití a replikaci rovněž hodila. Mohly by třeba chtít vědět, jak silná je momentálně naše imunitní odpověď, v jaké tkáni se nacházejí,… Na jednu stranu je pomyšlení, co všechno by si titěrní nano-trapiči mohli na nás připravit, deprimující. Na druhou stranu ale nám objev otevírá dveře k vymýšlení nového typu antivirotik - „klamavých antivirotik“. Doufejme, že i na znovu nám hrozící koronaviry.
Literatura
Elia Mascolo et al, The transcriptional regulator CtrA controls gene expression in Alphaproteobacteria phages: Evidence for a lytic deferment pathway, Frontiers in Microbiology (2022). DOI: 10.3389/fmicb.2022.918015
