|
 |
 |
|
Osamu Shimomura 1/3 ceny , USA Marine Biol. Lab. nar. 1928 |
Martin Chalfie 1/3 ceny , USA Columbia University nar. 1947 |
Roger Y. Tsien 1/3 ceny , USA San Diego, CA, USA nar. 1952 |
V skratke
V roku 1962 sa Osamovi Shimomurovi, spolu s jeho vtedajšími dvoma kolegami F. H. Johnsonom a Y. Saygom, podarilo po prvý krát z medúz druhu Aequorea victoria extrahovať žiarivý zelený fluorescenčný proteín (GFP) a opísať jeho vlastnosti. Aj vďaka Martinovi Chaldfieldovi je v súčasnosti tento proteín v mnohých oblastiach modernej biológie využívaný na zviditeľnenie neviditeľného – umožňuje na pokusných živočíchoch sledovať napríklad vývoj neurónov v mozgu, či šírenie sa nádorových buniek. GFP a jemu podobné proteíny, spolu s ich geneticky upravenými rôznofarebnými variantmi sa stali nenahraditeľnými biomarkermi vo výskume aktivity génov priamo v živom organizme.
Pomocou metód genetického inžinierstva sa gén pre zvolený fluorescenčný proteín vsadí do génu, kódujúceho inak neviditeľnú bielkovinu. Vďaka získanej luminiscencii ju vedci môžu sledovať ako detektívi. Kde sa v tele vytvára, kam migruje, kde sa hromadí a s čím interaguje. Zelený fluorescenčný proteín takto umožňuje sledovať životný cyklus a osudy o jeho gén obohatených buniek a príslušných tkanív. Metóda jedinečným spôsobom pomáha odhaliť, ako napríklad Alzheimerova choroba poškodzuje neuróny, ako pankreas vytvára bunky produkujúce inzulín, či dokonca ako sa vyvíja embryo laboratórneho zvieraťa. Zásluhou Rogera Y. Thiena sa podarilo umelo pripraviť bioluminiscenčné proteíny rôznych farieb. A tak vedci môžu na skúmanom živom organizme sledovať niekoľko biologických procesov súčasne.
Osamu Shimomura ako prvý izoloval zelený florescenčný proteín z medúzy Aequorea victoria a zistil, že pod ultrafialovým svetlom žiari jasnou zelenou farbou.
Martin Chalfie preukázal, že GFP sa v biológii môže v mnohých výskumoch uplatniť ako svietiaca genetická značka. Vo svojich prvých experimentoch pomocou GFP farebne označil neuróny pre hmatové receptory v priesvitnom tele hlístovca Caenorhabditis elegans (hlístice háďátko obecné). Ako prvý tak prakticky dokázal význam využitia fluorescenčného proteínu.
Roger Y. Tsien prispel k pochopeniu fluorescenčného mechanizmu GFP. Zároveň jeho rôznymi modifikáciami rozšíril paletu farieb, čo umožňuje vedcom označiť rôzne proteíny a bunky rôznymi farbami a sledovať rôzne biologické procesy súčasne.
Nekončiaci sa príbeh
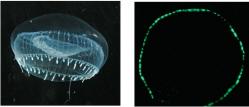
Medúzy druhu Aequorea victoria sa objavujú vo vodách Tichého oceánu pozdĺž celého západného pobrežia USA. Dospelé jedince dosahujú priemer asi 5 až 10 centimetrov. V období 60tych až 80tych rokov minulého storočia sa počas letných mesiacov vyskytovali vo veľkých húfoch, no odvtedy bol zaznamenaný výrazný pokles ich počtu. Už oddávna Aequorea púta pozornosť nielen vedcov. V noci totiž okraj jej polguľovitého tela tajomne nazelenavo fosforeskuje.
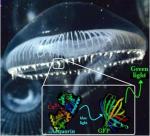
Za touto príťažlivou vlastnosťou sa ukrýva zaujímavý mechanizmus, ktorý odhalil najstarší z trojice laureátov, Osamu Shimomura. Medúza vlastne primárne produkuje svetlo modrej farby, ktoré je pre výsledný zelený bioluminiscenčný efekt nevyhnutné. Bunky medúzy uvoľňujú vápnik, ktorý sa viaže na zvláštnu malú bielkovinu – fotoproteín aequorin. V ňom dochádza k zmene molekulárnej štruktúry, pričom jej nová forma nie je stabilná a zodpovedá energeticky vyššej hladine. Preto dochádza k takmer spätnej zmene, pri ktorej sa uvoľní molekula CO2, vápnikový ión a energia vo forme svetla s vlnovou dĺžkou 400 až 470 nm. To odpovedá modrej farbe spektra. Ďalšie chemické procesy aequorin zregenerujú a celý cyklus prebieha nanovo. Prečo však medúza nesvetielkuje modrou farbou? Pretože do hry vstupuje ďalší hlavný aktér – zelený fluorescenčný proteín (GFP), ktorý modré svetlo pohltí a vyžiari zelené s hlavným maximom elektromagnetického žiarenia vo vlnovej dĺžke 505 nm, čo vnímame ako zelenú farbu.
GFP si jednoducho časť energie ponechá, pretože čím je vlnová dĺžka väčšia, tým je frekvencia nižšia a tým menšiu energiu má príslušné žiarenie. Takže GFP absorbuje svetlo s vyššou energiou a emituje s nižšou.
Príbeh Osamu Shimomuru o objave a izolácii aequorinu (v angličtine, neodporúčam čítať zanieteným ochrancom prírody): A Short Story of Aequorin
Od identifikácie a izolácie zeleného fluorescenčného proteínu GFP prešlo ďalších 15 rokov. Z molekulárnej biológie sa medzičasom aj vďaka novým technickým možnostiam a modernejším metódam stala rýchlo napredujúca veda. Zákonite musela dozrieť aj myšlienka, ako využiť fluorescenčné vlastnosti GFP. V roku 1987 napadla Douglasa Prashera: zakomponovať gén pre tvorbu GFP do génu pre tvorbu iného proteínu. Jednoducho vložiť sekvenciu DNA, ktorá kóduje GFP na koniec génu kódujúceho iný proteín, tesne pred takzvaný koncový stop-kodón, ktorý ukončuje program na tvorbu danej bielkoviny.
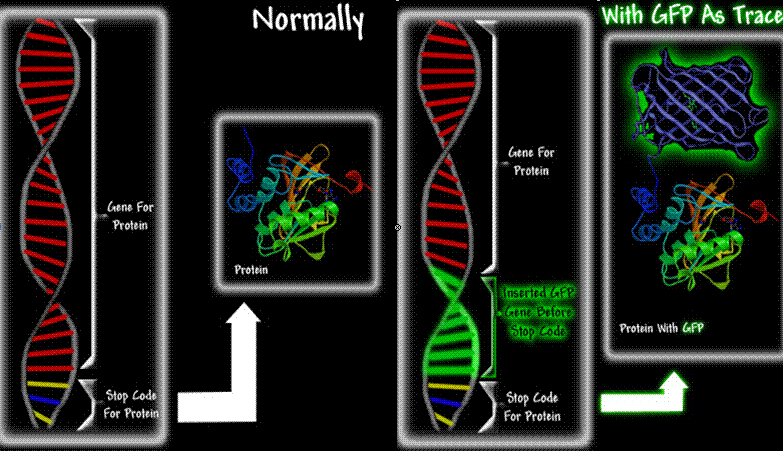
Po vložení sekvencie DNA, ktorá kóduje GFP do génu iného proteínu sa pri expresii takto upraveného génu vytvárajú obe bielkoviny, ktoré sú navzájom prepojené, ale vzájomne neovplyvňujú svoje pôvodné funkcie.
Táto myšlienka spôsobila v biológii malú revolúciu. GFP je veľmi malá molekula, takže takmer neovplyvňuje pohyb ani funkciu hostiteľskej bielkoviny. Je ľahko detegovateľná, lebo na jej zviditeľnenie stačí modré svetlo a nepotrebuje ďalšie látky ako iné typy bioluminiscenčných proteínov (napríklad aequorin potrebuje na svetielkovanie vápnik, luciferáza zas horčík, adenozíntrifosfát a luciferín). Vďaka grantu Prasher sekvenoval gén GFP a zistil, že je programom pre syntézu proteínu, ktorý sa skladá z 238 aminokyselín. Potom mu však dvojročný grant skončil a na rad sa dostal druhý z tohtoročných laureátov, Martin Chalfie.
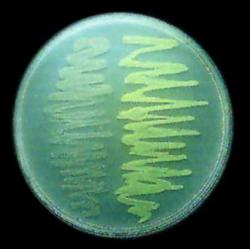
V dobe, keď Prasher začal sekvenovať gén pre GFP, Chalfie o proteíne získal len prvé letmé informácie. Tie v ňom však vzbudili vážny záujem. Keď po rokoch od Prashera získal vzorky osekvenovanej DNA fluorescenčného proteínu, podarilo sa mu úspešne zakomponovať gén GFP do genómu baktérie Escherichia coli. Takto geneticky zmodifikovaná kolónia baktérií svetielkovala po ožiarení modrým, alebo ultrafialovým svetlom známou zelenou farbou. Chalfieho tím začal gén GFP vsadzovať nie na koniec génu, pred stop-kodón, ale na jeho začiatok (za takzvaný promótor génu) čo sa v prevažnej miere používa dodnes. Chalfie túto metódu ako prvý použil pri označkovaní šiestich neurónov pre receptory hmatu drobného, ale medzi genetikmi známeho priesvitného červa Caenorhabditis elegans. Pozmenený gén pre hmatový neurón injekčne vstrekol do pohlavných žliaz dospelého červa (hermafrodita) a sledoval, ako sa to prejaví v ďalšej generácii zrodenej z nakladených vajíčok. Neuróny potomkov svetielkovali! Najdôležitejšie výsledky Chalfieho tím publikoval v roku 1994 v časopise Science.

Na scéne tohto príbehu sa objavuje Sergej Lukianov, ktorému sa podarilo odhaliť ďalšie, GFP podobné bioluminiscenčné proteíny. Tam, kde ich nik nehľadal – v koraloch (proteín DsRed) a v príbuzných sasankách (proteín Kaťuška, mKate). Oba emitujú červené svetlo. Za zmienku stojí, že Lukianov neorganizoval žiadnu expedíciu k pobrežiu nejakého oceánu, ale výskumný materiál kúpil v moskovských akvaristických obchodoch.
Vďaka tímu tretieho laureáta, Rogera Tsiena vytvárajú dnešné farebné variácie biofluorescenčných proteínov celú dúhovú škálu. Zaslúžil sa o lepšie poznanie fungovania GFP, no najmä vytvoril jeho farebné mutácie, ktoré v porovnaní s prírodným proteínom začínajú po ožiarení oveľa skôr svetielkovať a naviac sú podstatne jasnejšie.
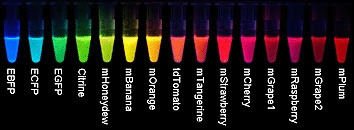
Genetické modifikácie pôvodného GFP proteínu a ďalších, jemu podobných bielkovín poskytli biológom celú farebnú škálu žiarivých luminiscenčných biomarkerov.
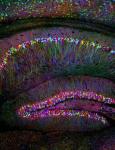
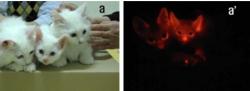
Pretože svetielkujúce proteíny sú drobné a netoxické, poskytujú obrovské možnosti pre výskum rozmanitých biologických procesov v živých organizmoch – napríklad skúmanie aktivity určitých génov, sledovanie funkcií bielkovín, rast nádorov a šírenie sa metastáz, či výskum konkrétnych štruktúr a procesov v mozgu. Ale doslova „vyrábame“ aj celé svetielkujúce organizmy. V roku 1999 sa hitom stali transgénne fosforeskujúce akváriové rybičky, svetlo sveta uzreli už aj svetielkujúce myši aj mačky, prasiatka či králik.
Niekoľko zaujímavých príkladov ponúka táto stránka s mnohými odkazmi na príklady použitia bioluminiscenčných proteínov na jej pravej strane. A k tomu ešte 11 videí.
BBC relácia o medúze Aequorea victoria: Programme 1 – Jellyfish, v angličtine
Zdroje:
Stránka Connecticut College – kompletná stránka o GFP
Stránka Nobelovej ceny za chémiu za rok 2008