Několik let byla na poli prionových chorob vcelku nuda. Nyní se během dvou měsíců roztrhl s články o BSE pytel. O kravské šílenosti se teď píše v těch nejprestižnějších časopisech (PLoS ONE, CELL,…). Jde přitom o práce, které mnozí označují za milníky v chápání prionových chorob, po kterých by mělo následovat období hojnosti – série dalších publikací s poznatky dovedenými až do praxe. K těm nejdůležitějším zjištěním patří poznatek Američanů z Texasu. Jde o zarážející jednoduchost, jakou lze ve zkumavce vytvořit nové kmeny prionů. Kmenů, které jsme dosud neznali a jež hravě překonávají mezidruhovou barieru, o níž jsme si mysleli, že je nepřekročitelná.
Američané z Ames (stát Iowa) zase doložili existenci atypické BSE, která je dědičná. To mimo jiné znamená, že matky tuto chorobu mohou přenášet na své potomky.
A konečně tu máme i švýcarsko-německý tým. Ten zase zaútočil na samotnou podstatu nemoci – vazbu prionového proteinu na buněčnou membránu. Dělá to pomocí takzvané kotvy a právě těmto evropským poznatkům je věnován tento článek.
Příčinou nemocí, jakou je například lidská Creutzfeld–Jakobova choroba, jsou priony. Prion je protein, který se přimyká k buněčné membráně. Přichycuje se k ní sacharidovou kotvou doplněnou o lipidovou komponentu (glycosylphosfatidylinositol, GPI). Kotvení prionu k membráně se zdá být tím, co má významný vliv na přeměnu normálního zdravého prionového proteinu v jeho patogenní infekční formu. Ta je pak příčinou klusavky ovcí, BSE u skotu, CWD jelenů,…
Christian F. W. Becker z Technické university v Mnichově a Peter H. Seeberger z Federálního technického institutu v Curychu zveřejnili zprávu, že se jim jako prvním podařilo v laboratoři vytvořit prion kotvený GPI kotvou.
V časopisu Angewandte Chemie jsou popsány detaily postupu, jímž lze takové kotvené proteiny syntetizovat. Počin je to zajímavý z toho důvodu, že se izolace kompletního prionu, navíc opatřeného kotvou, ještě nikomu nepodařila. Stejně tak se zatím nikomu nepodařilo sestavit toto poutací zařízení (kotvu) samostatně. Proto také i funkce tohoto poutacího vybavení proteinů zůstávala stále neodhalena. Možnost zkoumat tuto strukturu je považována za určitý zlom, který nám dovolí postoupit dál při odhalování tajů podstaty vzniku prionových chorob.
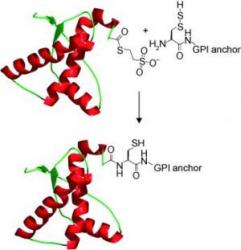
Kotvu, o které zde mluvíme a vyzdvihujeme důležitost její laboratorní syntézy, je totiž zařízení, které se u prionů přirozeně vyskytuje. Sestává se z pěti robustních částí. Jsou jimi cukerné stavební bloky. K nim jsou připojeny další cukry přes rozvětvené řetězce. Svoji úlohu zde však hrají také lipidy. O jejich účasti na stavbě kotvy se zatím nevědělo zhola nic.
Vědci si vzali do hlavy, že takovou konstrukci vytvoří uměle. Sestavili ji z pěti cukrů a osmnácti uhlíkatých lipidových řetězců. Základní prionový protein vyprodukovali za pomoci bakterií. Dodatečně pak k němu připojili thioester (skupinu obsahující síru).
Nová představa, jak by to v těle mohlo fungovat je, že by se protein s kotvou vázal na další protein pomocí chemické vazby. Šlo by přitom o přirozenou reakci, kde cysteinová skupina reaguje s thioesterem. Právě takové kotvení by mělo prionovému proteinu umožňovat přilepit se pevně k membránovým strukturám.
Nyní tedy vědci dokáží v laboratoři vyprodukovat dostatečné množství proteinů modifikovaných pomocí GPI kotev. Budou tak mít dostatek materiálu pro detailnější studium a pro pokusy s umělým prionovým proteinem. Ty by měly brzo odhalit, co se děje, když se prionový protein přimkne k buněčné membráně a jak toto spojení souvisí s jeho nechtěnou přeměnou (zašmodrcháním). To znamená, že se vědci přiblížili k odhalení vlastní podstaty proměny normálního prionového proteinu v jeho infekční formu.ˇ
Pramen: Becker et al. Semisynthesis of a Glycosylphosphatidylinositol-Anchored Prion Protein. Angewandte Chemie International Edition, 2008; DOI: 10.1002/anie.200802161
PLoS ONE, The Cell
