Kredit: Morgan Carlson a Irina Conboy, UC Berkeley
Studie, uskutečnéná na dvou významných universitách - Kalifornské v Berkeley a na Kodaňské, odhalila některé klíčové biochemické mechanizmy, spojené se stárnutím svalů. Jejich ovlivněním by se možná dal otočit chod biologických hodin svalové tkáně starších lidí. Článek na toto téma zveřejnilo včerejší vydání vědeckého časopisu EMBO Molecular Medicine, vydávaného Evropskou organizací pro molekulární biologii (European Molecular Biology Organization).
"Naše studie dokazuje, že když se svalovým kmenovým buňkám poskytne správná kombinace biochemických signálů, opět se nastartuje jejich schopnost regenerovat svaly u seniorů. Jako za dob jejich mladosti, " vysvětluje šéfka výzkumu, profesorka Irina Conboy. "To nabízí nové slibné cíle pro prevenci před tělo oslabující svalovou atrofií, která doprovází stárnutí, a možná tak i pro regeneraci jiných tkání poškozených degenerativními nemocemi."
Předchozí výzkum na zvířecích modelech dokázal, že schopnost dospělých kmenových buněk vykonávat své poslání - opravy a nahrazování poškozené tkáně, řídí molekulární signály, které dostávají od svého okolí. Tyto signály se s věkem mění, což způsobuje, že opravný systém selhává. Ale může být znovu nastartován právě pomocí zmíněných biochemických signálů.
To co platí pro myši, nemusí pro člověka. Lidský život trvá sedm až osm desetiletí, zatímco laboratorní myši hynou v druhém roce svého života. Nyní se ukázalo, že i u člověka, stejně jako u hlodavců, fungují stejné, prastaré, evolučně zakonzervované mechanizmy.
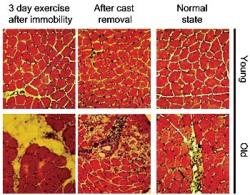
Vědci naverbovali 30 věkově vhodných zdravých mužů v dobré fyzické kondici a rozdělili je do dvou skupin. Mladíky ve věku 21 až 24 let (průměr 22,6 let) a muže zralé, 68 až 74leté (s průměrem 71,3 let). Na začátku pokusu jim provedli biopsii čtyřhlavého stehenního svalu (quadricepsu), jinými slovy, odebrali vzorky svalové tkáně. Zkoumanou nohu pak každému jednotlivci na dva týdny znehybnili – zavázali ji do pevné formy, aby si v ní mohly svaly, nenamáhané pohybem, v klidu ochabovat (atrofovat). Když byly končetiny po 14 dnech z neohebného vězení vysvobozeny, jejich majitele čekalo systematické, dlouhodobé cvičení na posilovacích strojích. Aby svaly nohou znovu nabraly na hmotě a síle. První tři dny a pak po čtyřech týdnech od začátku tréninkové fáze pokusu vědci opět udělali odběry vzorků tkáně ze stejného svalu.
Výsledky laboratorních analýz ukázaly, že před znehybněním končetin byla ve svalové tkáni starších osob, v porovnání s mladými, jenom polovina kmenových buněk schopných opravovat poškození. Tento rozdíl byl v průběhu posilujícího cvičení ještě vyšší – „mladší“ svaly měly čtyřikrát víc regeneračních kmenových buněk schopných odstranit následky ochabnutí. Ve „starých“ svalech náhlé intenzivnější cvičení nejen že dostatečně nezaktivovalo kmenové buňky, ale dokonce vyvolalo zánětlivé procesy a způsobilo mírné poškození tkáně. Vznikly v ní drobné trhlinky a jizvy. V porovnání s mladými, u starších lidí byla svalová atrofie rychlejší a následky výraznější a trvalejší. I pozitivní vliv cvičení byl mnohem slabší. Mladé svaly dva týdny nehybnosti postihly jen mírně a následné posilování snadno vedlo k nápravě. Výsledek experimentu tedy nabízí poučení: s přibývajícím věkem bychom se stále nekompromisněji měli snažit udržet si dobrou fyzickou kondici. Protože ve stáří dlouhodobá nečinnost může vést k nezvratnému poškození regenerativních schopností svalových kmenových buněk a pak je posilování již ochablých svalů mnohem méně účinné. Vědci však seniory zároveň varují i před příliš intenzivním cvičením hned po delší době omezeného pohybu. To totiž může vést k zánětům až k mechanickému poškození svalové tkáně.
Kredit: Morgan Carlson a Irina Conboy, UC Berkeley
Výzkum kromě těchto, celkem logických a předvídatelných závěrů přinesl i zajímavé poznatky o reakcích lidského svalu na biochemické podněty. Již dávno biologové znají a mají prozkoumané receptory Notch na povrchových membránách buněk všech mnohobuněčných eukaryotů. Savci mají 4 druhy těchto receptorů Notch1 až Notch4, jenž umožňují buňce přijímat signály z okolí a komunikovat se sousedními buňkami. Signální dráhy Notch jsou pro „osudová rozhodnutí“ buňky klíčové. „Navigují“ ji v průběhu embryonálního vývoje a tak vlastně pomáhají „dirigovat“ vznik nového organismu, aby vše bylo tak, jak má. Ale spolupodílejí se i na správném chodu a údržbě orgánů dospělého těla. Není divu, že poruchy signálních drah Notch v důsledku mutací v jejich genetickém programu vedou k řadě závažných onemocnění.
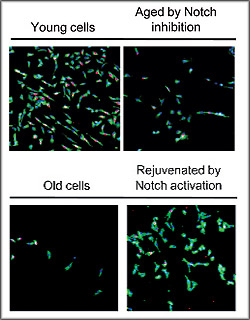
Z předchozích studií vědci věděli, že aktivace receptoru Notch na povrchu svalových kmenových buněk spouští růst nové svalové tkáně. Kmenové buňky ale mají i receptor pro protein TGF-beta (Transforming Growth Factor Beta), který ovlivňuje několik funkcí v buňce, zejména její růst a dělení. Zvýšená aktivace tohoto TGF-beta receptoru spustí řetěz biochemických reakcí, které v konečném důsledku potlačí schopnost buňky se dělit. U myší je stárnutí spjaté s postupným poklesem aktivity Notch receptoru a naopak, se zvýšením hladiny TGF-beta proteinu. To zablokuje schopnost kmenových buněk obnovovat poškozenou tkáň. Výzkum potvrdil, že u lidí tento mechanizmus funguje stejně jako u myší. Ale taky odhalil, že důležitým regulátorem aktivity receptoru Notch je mitogenem aktivovaná protein-kináza (KMAP), nevyhnutná pro obnovu svalové tkáně. Mitogen je chemická látka, povětšinou protein, který zvenčí motivuje buňku k jejímu dělení tím, že aktivuje příslušnou signální dráhu a uvnitř buňky „probouzí“ konkrétní kinázu k její činnosti – k přenosu fosfátové skupiny PO4 ze skladu energie, od adenozintrifosfátu, k cílovému proteinu. Tím různé kinázy regulují důležité pochody v buňce. Od exprese genů, přes růst a dělení buňky, obranu před vnějšími stresovými faktory až po apoptózu, čili buněčnou smrt.
Protože ve svalech seniorů je hladina mitogenem aktivované protein-kinázy nízká, receptor Notch není dostatečně aktivován a kmenové buňky si své regenerační poslání nevykonávají tak, jak to dokázaly zamlada.
Působeni kinázy MAPK si vědci ověřili na buněčných kulturách. Když snížili její hladinu v kultivačním médiu s mladými svalovými buňkami, ty se přestaly regenerovat. Přidání kinázy ke kultuře starých buněk, výrazně jejich regeneraci podpořilo.
Návaznost aktivit kináza MAPK –> receptor Notch –> kmenové buňky se zachovala po dlouhou dobu evoluce od nejjednodušších červů až k člověku. To svědčí o důležitosti tohoto mechanizmu, který hraje klíčovou roli v regulaci a stárnutí regeneračních schopností tkání. Z výzkumu, kromě poučení a nových poznatků vyplývají i cíle pro další klinické studie. Jak konkrétně MAPK a Notch využít k zlepšení fyzické kondici lidí ve vyšším věku.
Zdroje: University of California, Berkeley , EMBO Molecular Medicine