Opsáno od řas
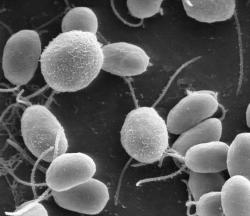
Chlamydomonas reinhardtii je jednobuněčná zelená řasa o níž není na Zmi nouze. Najdeme ji na všech kontinentech. Má český ekvivalent rodového jména ale moc s ním neuspějete, protože někdo se kloní k "pláštěnce" jiný zase ke "koulence“. Ať tak či tak, buňka se dvěma bičíky si pod různými jmény bude i tak žít jak ve vodě i vlhké půdě. Někdy samotářsky, jindy v malých neorganizovaných koloniích. Rozmnožovat se bude, jak je u primitivních organismů běžné, prostým dělením. V čase nepohody, nebo když bude strádat nedostatkem dusíku začne tvořit pohlavní buňky (gamety). Gamety tohoto organismu jsou sice dvou typů, ale velikostně, a tvarem nerozlišitelné a tak se jim ani samčí a samičí neříká a volí se indiferentní značení znaménky + a -.

Vědci se domnívají, že právě zde je třeba hledat počátek vzniku pohlaví a sexu, jak ho známe u složitějších organismů. I řase se ale jejím jednodušším způsobem daří zajistit splynutí gamet dvou jedinců - tedy kombinovat geny za vzniku zygoty. Ta oplývá dvěma sadami chromozómů. U pláštěnky (koulenky) je tato forma „spící zygotou“ čekající na lepší časy. S novou kombinací genů se pak pokouší uspět v novém prostředí. Tam se již ale zase začne množit pro řasy typickým dělením za vzniku známých bičíkatých buněk obsahujících jen jednu sadu - tedy sedmnáct krátkých chromozómů.
Tentokrát ale vědce více než intimnosti sexuálního života řas zaujala jejich schopnost se orientovat podle světla.
Channelrhodopsin
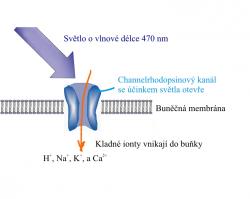
Zelené řasy mají raději světlo než tmu a protože mají bičík, využívají ho ke svému přemísťování, odborně řečeno fototaxi. Aby řasám jejich vrtidla byla něco platná, musí znát pojem orientace a mít k tomu patřičná čidla. Oko by se na jejich asi 10 mikrometrů velkých tělech nevyjímalo dobře a tak si musí vystačit se světločivnou skvrnou. Před deseti lety v ní vědci našli zvláštní protein. Je součástí buněčné membrány a když na něj svítí světlo, v části molekuly odvozené od vitamínu A se změní konformace a vytvoří se izomer. Proměna trans formy na cis udělá v membráně malinkou dírku. Dost velkou na to, aby vzniklým kanálkem o průměru 0,6 nm se do buňky nahrnuly kladné ionty (H+, Na+, K+, a Ca2+). Otevření dvířek do nitra buňky trvá jen milisekundu, pak se zase přibouchnou. I tak krátká doba protonovým vetřelcům stačí k tomu, aby buněčnou membránu depolarizovali. Pokud se vám při slově depolarizace membrány vybavil neuron a šíření nervového vzruchu, pak byla vaše intuice zcela správná. Příkazy z řídících center jsou předávány výkonným buňkám nervovými dráhami a jejich podstatou je právě depolarizace membrán.
Transplantace proteinu z řas na buňky živočišné

Vědce napadlo molekuly channelrodopsinu vpravit do savčích buněk. Vybrali si k tomu ty buňky, které jsou zvyklé poslouchat příkazy “shora” tlumočené nervovými impulsy. U jiných by to totiž nemělo smysl, taková buňka rohoviny na nic nedpoví i kdyby jí přemlouvali. Dostat protein do buněk aby se v nich jen tak sem tam poflakoval by také nebylo nic platné. Bylo třeba z proteinu udělat integrální součást buněčné membrány. I k tomu již dnes existuje náčiní v podobě plasmidů - vektorů genetické informace. Jsou to elementy tak trochu podobné virům, do jejichž genetického kódu byl vložen gen pro tvorbu požadovaného proteinu. Pokusy s tímto vpravováním cizího proteinu do membrány buněk se daří a tak již v několika laboratořích mají geneticky upravené buňky, které ve své membráně channelrhodopsin mají. U takto modifikovaných buněk lze činnost nervů nahradit (imitovat) světelnými impulsy.
Vylepšení buněk kosterního svalstava
Když vědci z MIT a University státu Pennsylvania stáli před volbou na které tkáni začít pokusničit, přiklonili se k myšlence, že by z toho mělo být něco praktického. Rozhodli se pro svaly které jsou silné a pracují rychle. Těmi jsou obyčejné buňky které jsou ve svalech na končetinách. Za běžné situace k nim neurony vysílají pokyny. Někdy ale nemoc nebo úraz toto spojení přeruší. Traumatologická pracoviště se již dlouho snaží řešit takovou zrátu inervace pomocí elektrod. Vyvíjejí se elektrody z křemíku s integrovanými legovacími atomy do krystalové mřížky (například lithiem) nebo se na skleněná vlákna nanáší vrstva grafenu, případně se vylepšují staré dobré kovové elektrody. Poznatků v tomto směru je habaděj. I když jde pokyny tímto způsobem přenášet také, je to v případě zamýšleného využití k pohonu minirobotů nepraktické a přináší to spoustu komplikací. Například s napájením elektrod. Volba proto logicky padla na optogenetiku. Termín pochází od Eda Boydena z MIT a Karla Deisserotha ze Stanfordovy univerzity, kteří v roce 2005 „naučili“ geneticky modifikované neurony reagovat na krátké laserové pulsy. Harry Asada se svými spolupracovníky se pokusili o totéž, jen místo neuronů znásilňovali buňky kosterního svalu. Upravili myoblasty stejně jako jejich předchůdci - pomocí plasmidů. Dávali jim je do živného media a jak myoblasty rostly a propojovaly se do dlouhých vláken, plasmidová „infekce“ je vylepšila o světelná čidla.
Pochopitelně, že při pulsech modrého světla se jim dostalo stejné depolarizace, jako kdyby k nim dospěl elektrický vzkaz připojeného neuronu. Proto se na světelný signál začaly stahovat. Na slabé dvaceti milisekundové světelné záblesky reagovala jen jednotlivá svalová vlákénka (soubuní), na něž byl paprsek zacílen. Při plošném posvícení to "šilo se všema, jako při posvícení“.
Sval
Něco jiného je chování buněk na Petriho misce a něco jiného je práce svalu. Zda se bude chtít buňkám cvičit na povel i v reálu muskulatury si vědci vyzkoušeli na 3D svalové tkáni. Vypěstovali si ji z geneticky pozměněných myoblastů kultivací v hydrogelu. K imitaci napojení na kostru si vyroblili čip opatřený prohlubněmi k ukotvení svalových vláken. Ukázalo se, že bezdrátové světelné spojení funguje spolehlivě i ve formaci umělého svalu, který se ohýbá a kroutí podle toho, které z jeho částí se dopřeje světelná show.
VIDEO Sval reagující na světelné pulsy (Sakar a kol., 2012)

Podle vědců jsou umělé svaly cestou k tvorbě titěrných a velice mrštných strojů, které budou shopny vykonávat pokyny i v tak stísněných tělních prostorech jakými jsou třeba cévy. Nějakou dobu to možná ještě potrvá, ale nemusí to být dlouho. První pokus Asadova týmu na videu ukazuje 10 stupňů volnosti v prostoru menším než jeden milimetr. Takovou obratnou miniaturizací se zatím žádná jiná pohonná jednotka chlubit nemůže. Kritici poukazují na malou sílu stávajících kontrakcí a nedořešenou otázku životnosti takových zařízení. Pravdou ale také je, že tyto roboty by se měly částečně (alespoň co se buněk týká) opravovat samy a přečkat v pokus 14 dnů jim nečinilo problém. V každém případě máme o čem přemýšlet. Doba uměle pěstovaných a vylepšovaných orgánů pomalu nastává a ne ke všem půjde přivádět “dráty” - ať už ty kovové, nebo klasické z nervů. Optogenetice se tu otevírá velké pole působnosti a někteří vědci její zavádění přirovnávají k začátkům éry mobilních telefonů.
Stále nová pracoviště hlásí pokusy s jinými channelrhodopsiny. Dělá to dojem, že co mikroorganismus reagující na světlo, to specifický channelrhodopsin. Muselo se proto přikročit k jejich nálepkování. Ten náš, o kterém je tento článek, dostal číslo dvě. Je specifický tím, že reaguje na modré světlo 480 nm. Vědci již mají k dispozici proteiny citlivé na jiné vlnové délky a upravené mutacemi tak, že po impulsu nechávají kanálek otevřený mnohem déle. Dokonce část molekuly channelrhodopsinu, která je zanořena do cytoplasmy a není tak cimprlich na zacházení a úpravy aniž by to změnilo funkci, vědci již obarvují fluorescenční barvičkou. To jim dovoluje lokalizovat umístění a počty vpašovaných membránových dvířek a sledovat jejich činnost na živých preparátech.
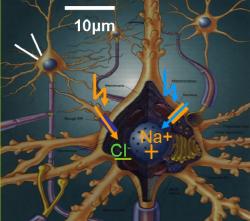
Zatímco channelrhodopsiny z řas reagují na modré světlo a membránu depolarizují, protein halorhodopsin získaný z archaebakterie Natronomonas pharaonis reaguje na žluté světlo o vlnové délce 580 nm. Ten otevírá kanál pro chloridové ionty a způsobí hyperpolarizací membrány, která účinek modrého světla zruší... ale o tom až někdy příště.
U novinek, které mohou lidské schopnosti vylepšit se v poslední době stává pravidlem, že než se praxe rozkouká, medicinmani vrcholového sportu s tím dávno experimentují. Možná bychom si měli začít všímat, zda se těm s medailemi na krku při focení "na bedně" nezačne po blesku někde něco cukat...
Prameny:
VIDEO: Přednáška Harryho Asada věnovaná Bio-botům, robotickým zařízením využívajícím živé buňky. (až od čtvrté minuty záznamu)
Ernst Banberg: Optogenetika