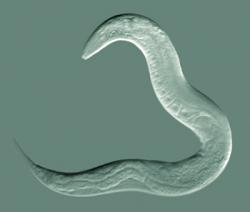
Tento mikroskopický červík učaroval vědeckému světu již před několika desetiletími. Má řadu anatomických a fyziologických vychytávek, pro výzkum jako dělaných, a je ochoten růst a množit se v laboratoři ve velkém. Caenorhabditis elegans se brzy stalo důležitým nástrojem v genetice, vývojové biologii, výzkumu stárnutí i řadě dalších oblastí a své místo na slunci si s přehledem udržuje i dnes. Se svými skromnými 302 neurony1, které mu ovšem nezabránily v podílu na 3 Nobelových cenách, je i důležitým modelem v neurologii. Červí neurony jsou překvapivě podobné těm savčím. Podstatné rozdíly se však najít dají - třeba to, že axony háďátek nejsou chráněny myelinem. Proto například roztroušenou sklerózu, při které dochází k autoimunitní degeneraci myelinových pochev, v červech příliš dobře zkoumat nemůžeme.
Modely Alzheimerovy choroby
V jiných případech, jako třeba u Alzheimerovy choroby, je však situace jiná. Červí modely neurodegenerace se nevyznačují tím, že by si snad častěji zapomínaly klíče či přestaly rozpoznávat některé ze svých stovek nejbližších příbuzných, nýbrž například akumulací některých peptidů/proteinů. Ty se hromadí také v nervových buňkách pacientů trpících touto nemocí. Mezi ně patří například β-amyloid. Jedná se o krátký peptid vzniklý špatným naštípáním proteinového prekurzoru APP, který se v nervových buňkách běžně vyskytuje a je nezbytný pro jejich správné fungování. Zlobivé fragmenty se vzájemně propojují a tvoří škodlivé plaky. Háďátka podobný protein samy mají, k podobné fragmentaci u nich ale nedochází. Škodolibí vědci však našli způsob, jak tento problém obejít a červy přesvědčili, aby lidskou formu tohoto peptidu produkovali ve svalech. Následkem toho je pak narušení funkce svalů a progresivní paralýza, která se začne objevovat už po několika hodinách. Takovýto model byl následně využit k hledání genů nebo celých molekulárních drah, které toxicitu β-amyloidu nějakým způsobem ovlivňují.
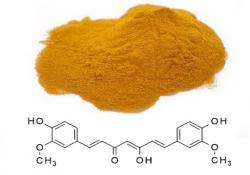
Tam ale legrace nekončí – stejná mutantní červí linie nám může pomoct i při hledání látek, které by následně mohly být využívány k terapii. Příkladem takových látek, které paralýzu u červů zpomalily, jsou třeba kurkumin, pojmenovaný podle indického koření, ve kterém se hojně vyskytuje, nebo epigalokatechin galát, který můžeme najít ve svém ranním šálku zeleného čaje.
Za zmínku stojí určitě také to, že výzkum na červích mutantech s vyřazeným genem Sel-12 pomohl také identifikovat enzym podílející se na štípání APP. Mutace v jeho DNA předloze zřejmě vedou k formaci většího množství škodlivě působících fragmentů.
Dalším proteinem, který dělá neplechu v neuronech pacientů s Alzheimerovou chorobou je tau protein. Ten má ostatně prsty i v řadě dalších oemocnění, které souhrnně zvány jako tauopatie. Tau obvykle napomáhá v neuronech se stabilizací cytoskeletu. V nemocných neuronech je tau pozměněn, což vede k jeho větší touze po fosfátových skupinách. Hyperfosforylace opět ve finále vede ke vzájemných reakcím a formování agregátů. I v tomto případě zvídaví výzkumníci vyzkoušeli, co se stane s háďátkem, které ve svých neuronech produkuje lidskou formu tohoto proteinu, a to jak zdravou, tak mutantní. Takto upravení, nebo možná spíše pokažení, červi v obou případech ztrácejí schopnost koordinovaně se pohybovat a dříve umírají. U jedinců s mutantní formou se tomu však děje mnohem rychleji. V případě, že tau protein exprimujeme pouze v 6 červích neuronech, jež zodpovídají za reakce na dotek, získáme dokonce téměř ukázkově normální jedince se zdravou formou tau, zatímco háďátka s mutantním proteinem si šťouchání téměř nevšímají.
Stejně jako v případě beta amyloidu i zde tyto modely pomohly s identifikací interakčních partnerů proteinu a i s hledáním potenciálních léků. Jednou z látek snižující toxicitu tau je třeba neuroleptikum azaperon.
Modely Parkinsonovy choroby
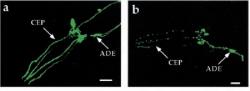
Výzkum s háďátky se zdaleka nespecializuje jen na Alzheimera. Řada červích modelů již existuje i pro Parkinsonovu chorobu. Tyto modely mohou být založeny na cíleném poničení dopaminergních neuronů pomocí toxinů s nelíbivými jmény jako je 6-hydroxydopamin, 1-methyl-4-fenylpyridinium nebo rotenon. Vzhledem k tomu, že háďátka mají průhledné tělo, lze toto poškození sledovat víceméně v přímém přenosu, a abychom lépe viděli, můžeme si na buňky i posvítit zeleným fluorescenčním proteinem. Mezi látky schopné snížit vliv těchto toxinů patří například kyselina lipoová, vitamin C nebo i hojně využívaný lék proti bolesti paracetamol.
Jiným možným přístupem je zaměřit se na některé kinázy, enzymy zodpovědné za fosforylaci proteinů. Mutace v jistých kinázách jsou spjaty s dědičnými formami parkinsonismu. Červi mají jejich vlastní verze, do určité míry podobné těm lidským. Vyřadíme-li je z funkce, můžeme získat řadu hlubších informací o funkcích těchto kináz a jejich vzájemných interakcích. Ty naznačují například propojenost Parkinsonovy choroby s fungováním mitochondrií, oxidativním stresem nebo UPR (unfolded protein response). Zvláště populární je kináza LRRK2. Ta byla jak ve zdravé, tak ve dvou nemocných lidských variantách vložena do genomu háďátek, kde způsobila degeneraci dopaminergních neuronů, změny v chování červů nebo změny v citlivosti k některým z výše jmenovaných toxinů. Projevy byly u mutantních forem odlišné. I tyto linie byly využity pro identifikaci inhibitorů LRRK2, které by mohly v budoucnu pacientům s těmito mutacemi pomáhat.
Dalším proteinem, který je s Parkinsonovou chorobou úzce spjatý je α-synuclein. Ten běžně napomáhá uvolňování neurotransmiterů nebo stabilizaci membrány neuronů. I u něj existují mutace, jež jsou propojené s dědičnými formami onemocnění, kdy se protein neposkládá kultivovaně do funkčního tetrameru, ale opět vytváří nebezpečné shluky. Červi podobný gen nemají, ale zákeřní vědci si opět vypomohli genetickou modifikací. V některých případech ještě proteinu přidali i fluorescenční ocásek. Tvorba alpha-synucleinu v červích nervových buňkách má řadu různých snadno pozorovatelných projevů, v závislosti na tom, do jakého typu neuronu se rozhodneme jej háďátkům podstrčit. I zde se podařilo s pomocí těchto linií zjistit více o tom, jak protein přispívá svou troškou do mlýna k patologii Parkinsona a identifikovat jeho spolupachatele nebo naopak geny “podezřelé” z neuroprotekce, jejichž nakopnutím by se možná daly projevy nemoci zmírnit.
A ještě další modely...
Principiálně podobné přístupy - tedy exprese lidské verze genu spjatého s chorobou, nebo alespoň některými jejími dědičnými formami, případně fluorescenční značení a sledování změn lokalizace a chování - byly uplatněny i u dalších nemocí. Patří mezi ně amyotropická laterální skleróza, onemocnění projevující se degenerací motorických neuronů a postupnou paralýzou. Dále pak Huntigtonova choroba, dědičné onemocnění způsobené zmnožením nukleotidových tripletů v genomu. Dokonce existují červí modely pro prionová onemocnění. I v těchto případech se s pomocí pozměněných červů podařilo získat cenné informace o genech, jejichž exprese s nemocí souvisí.
Je určitě rozumné udržovat si vzhledem k očividné rozdílnosti mezi savci a háďátky určitou skepsi. Zatím to však vypadá, že nám jednoduší červi poměrně efektivně pomáhají, a snad nadále budou pomáhat, pochopit mechanismy tak komplikovaných onemocnění, jako jsou ta neurodegenerativní. Pokud navíc zkombinujeme jejich příhodné rozměry a anatomii s pokrokem v mikroskopii a metodách obrazové analýzy, mohli bychom v budoucnu získat systém vhodný pro rychlý a vysokokapacitní in vivo screening potenciálních léčiv. Snad tedy i díky háďátkům bude budoucnost pro naše mozky vypadat jen a jen růžověji.
1 U hermafroditů, samci jsou o 91 neuronů „chytřejší"
Zdroje:
Teschendorf, D., & Link, C. D. (2009). What have worm models told us about the mechanisms of neuronal dysfunction in human neurodegenerative diseases. Molecular Neurodegeneration, 4(1), 1-13.
Wolozin, B., Gabel, C., Ferree, A., Guillily, M., & Ebata, A. (2011). Watching worms whither: modeling neurodegeneration in C. elegans. Progress in molecular biology and translational science, 100, 499.
Li, J., & Le, W. (2013). Modeling neurodegenerative diseases in Caenorhabditis elegans. Experimental neurology, 250, 94-103.
Braungart, E., Gerlach, M., Riederer, P., Baumeister, R., & Hoener, M. C. (2004). Caenorhabditis elegans MPP+ model of Parkinson’s disease for high-throughput drug screenings. Neurodegenerative diseases, 1(4-5), 175-183.
Yao, C., Johnson, W. M., Gao, Y., Wang, W., Zhang, J., Deak, M., ... & Chen, S. G. (2013). Kinase inhibitors arrest neurodegeneration in cell and C. elegans models of LRRK2 toxicity. Human molecular genetics, 22(2), 328-344.
Alavez, S., Vantipalli, M. C., Zucker, D. J., Klang, I. M., & Lithgow, G. J. (2011). Amyloid-binding compounds maintain protein homeostasis during ageing and extend lifespan. Nature, 472(7342), 226-229.
Brown, M. K., Evans, J. L., & Luo, Y. (2006). Beneficial effects of natural antioxidants EGCG and α-lipoic acid on life span and age-dependent behavioral declines in Caenorhabditis elegans. Pharmacology Biochemistry and Behavior, 85(3), 620-628.