Ohňostroje utichly, místy dokonce nasněžilo a věda se rozjíždí na plné obrátky i v roce 2016. Díky silvestrovskému číslu časopisu Science nemusíme pochybovat o tom, že nadcházející rok bude opět rokem báječných objevů, například v bouřlivě se rozvíjejícím genetickém lékařství. Právě v tomto čísle časopisu Science se totiž objevil skvělý počin genomových editorů z Dukeho univerzity, kteří poprvé v historii vyléčili genetické onemocnění u dospělého a veskrze živého savce.
Vlastně nikoliv „vyléčili“, ale „spravili“. Genetické onemocnění není žádná nemoc. Je to porucha, mutace, omyl, chyba v buněčné mašinérii, která nefunguje, jak by měla. Někteří lidé mají prostě smůlu a narodí se s chybou v sekvenci DNA, která má, narozdíl od mnoha jiných, fatální důsledky. Až doposud jsme byli odsouzeni do role pozorovatelů, kteří sledují, jak dramatické má ta či ona porucha na úrovni DNA důsledky. Mohli jsme maximálně snažit napravovat důsledky genetických poruch, naše možnosti ale byly vždy jen omezené. Řada genetických poruch vede k nevyhnutelné a nemilosrdné předčasné smrti.
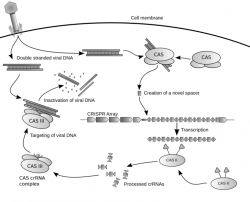
Když se před pár lety objevil první univerzálně použitelný genomový editor CRISPR, tak bylo jasné, že je jenom otázkou času, kdy budeme schopni genetické poruchy opravit. A ten čas právě nastal, symbolicky s úsvitem Nového roku 2016. Charles Gersbach a jeho tým se vrhli na laboratorní myši s Duchenneovou muskulární dystrofií a tuhle závažnou genetickou poruchu jim v historicky významném experimentu prostě opravili. Použili přitom technologii, se kterou by bylo možné opravit genetické poruchy i u lidí. Po nezbytných úpravách, samozřejmě.
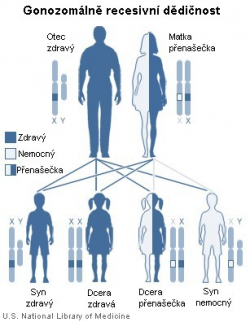
Duchenneova muskulární dystrofie (DMD) je porucha genu pro dystrofin, který sedí na pohlavním chromozomu X. Tvoří ho 2,4 milionů párů bází a jeho transkripce, tedy přepis do RNA trvá neuvěřitelných 16 hodin. Tento gen zahrnuje celkem 79 exonů, čili kódujících oblastí DNA. Složením všech těchto exonů dohromady vznikne dystrofin, obludně veliký protein, který hraje významnou roli v membráně svalových buněk, kde zajišťuje propojení mezi vnitrobuněčnými a mezibuněčnými elementy. Je to vlastně vůbec největší lidský protein.
Potíž je v tom, že stačí, aby nefungoval jediný ze zmíněných 79 exonů, a celý dystrofin je prakticky k ničemu. Mutace v DMD mají gonozomálně recesivní dědičnost, takže přenašeči poruchy jsou zdravé matky. Protože je ale gen pro dystrofin tak strašně veliký, tak v něm může dojít k mutaci s vyšší pravděpodobností, nežli u kratších genů. DMD se tudíž často objevuje i v rodinách, kde ani jeden z rodičů nemá zmutovaný gen pro dystrofin. Výsledkem toho všeho jen, že se s Duchenneovou muskulární dystrofií narodí jeden chlapec z několika málo tisíc, což z ní dělá nejčastější typ svalové dystrofie. Smrt postižených obvykle nastává mezi dvacátým a třicátým rokem života, kvůli srdeční nebo dechové nedostatečnosti.
Právě badatelé Dukeho univerzity již dříve dokázali opravit DNA buněk pacientů s Duchenneovou muskulární dystrofií, a týmy jinde ve světě zase zvládly opravit DNA jednobuněčných embryí. Jenže vložit opravené buňky zpátky do tkání pacientů, a zařídit, aby fungovaly, není ani trochu snadné, o editování embryí ani nemluvě. I v dnešní době si spousta lidí bůhvíproč myslí, že zachraňovat nenarozené děti před genetickými poruchami je neetické. Jenže na Dukeho univerzitě jsou pašáci a vytvořili transportní systém pro genomový editor CRISPR, který je založený na geneticky upravených a odzbrojených virech AAV (adeno-associated virus). Právě s tímhle transportním systémem lze překonat většinu zásadních překážek, které doposud bránily úspěšně léčbě, tedy opravě genetických poruch u lidí.
Gersbach se ani moc nediví, že se kolem editování DNA editorem CRISPR rozbouřily etické debaty. Pro člověka v jeho kůži musejí být podobné záležitosti denním chlebem. Jeho názor je ale naprosto jasný. Používání genomového editoru k léčbě lidí, kteří se již narodili s těžkou genetickou poruchou, jako je právě smrtelná Duchenneova muskulární dystrofie, je naprosto bez debaty. Pokud s tím má někdo problém, nechť jde za pacienty a vysvětlí jim, že kvůli bioetice musejí pomalu zemřít.
Gersbach a spol. opravili laboratorní myši. Podle všeho by ale jejich technologie měla fungovat i u lidí. Nepůjde to samozřejmě úplně snadno a nebude to hned. Do vytvoření použitelné léčby DMD a ostatních genetických poruch u lidí zbývá spousta náročné práce. Všechno bude nutné pořádně vyzkoušet a ověřit, aby léčba nezpůsobila více škody než užitku. Doufejme jen, že administrativa nebude klást genomovým inženýrům do cestu více překážet, než kolik je doopravdy nezbytně nutné. Dítě s Duchennenem i jinými genetickými poruchami se ostatně může narodit do každé rodiny. Pro pacienty s genetickými poruchami je to od této chvíle závod s časem.
Video: Genome Editing with CRISPR-Cas9
Video: Redesigning the Human Genome
Literatura
Duke University 31. 12. 2015, Science online 31. 12. 2015, Wikipedia (CRISPR, Duchenne muscular dystrophy)