Pro úspěšnou reprodukci je zapotřebí vitálních pohlavních buněk a není šokující, že spermie i vajíčka potřebují pro svůj zdárný vývoj blahobyt v podobě dostatečného přísunu energie. Pro pohyblivé spermie je jistě žádoucí, aby mitochondrií bylo dost a správně dýchali – respirovali. Spermie je ale vybavena na dlouhou pouť k vajíčku jen desítkami mitochondrií. To je v přísném kontrastu s vajíčkem, které obsahuje více než 100,000 mitochondrií, což je ekvivalent 100 – 1000 somatických buněk ostatních tkání (např. epitelových buněk pokožky nebo jaterních hepatocytů). Na to, že se vajíčko aktivně nehýbe, je to enormně vysoké číslo. K tomu mitochondrie vajíčka nerespirují, a tak se tahle mitochondriální opulentnost zdá jako postradatelná.
Ještě než se pustíme do přísných soudů, snad stojí za zopakování, že mitochondrie vznikly endosymbiózou archebakterií s hostitelskou buňkou již před 2 mld. let. Není pochyb, že endosymbióza a další specializace byly hybnou silou eukaryotizace buněk a bez nich bychom rozhodně nebyli tím čím jsme. Během evoluce pohlavního rozmnožování se osvědčilo dědit mitochondrie po mamince, a tedy z vajíčka. Za tímto dědictvím stojí mitochondriální DNA (mtDNA), která postupně ztratila většinu genů a zredukovala svůj genom na pouhých 37 genů. Je to nepatrné množství oproti obrovskému genomu jádra (více než 20 tis. genů), kde mimochodem skončily tisícovky původně mitochondriálních genů. Ale zpět k otázce: je této hrstky genů opravdu zapotřebí? Neobejdeme se bez nich?
Nepřekvapí, že nikoliv – mutace v mtDNA vedou k závažným onemocněním často s neurodegenerativními a/nebo motorickými projevy. To poukazuje na nutnost bezvadného mitochondriálního genomu v nervové soustavě a muskulatuře. Ovšem z nervových buněk nebo svalových vláken mitochondriální genom nezdědíme a jakékoliv mutace jsou slepou uličkou pro jejich dědičnost. Na rozdíl od těchto buněk existují takové, které se bez mitochondrií zcela obejdou – erytrocyty se nechají unášet proudem krevního řečiště a veškerou svojí drahocennou cytoplazmu věnují hemoglobinu.
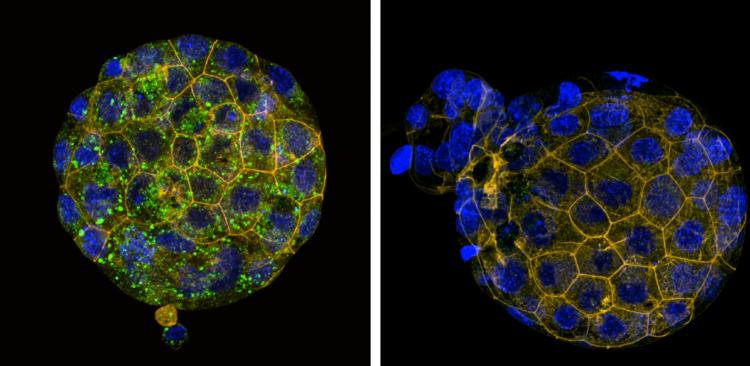
Pětidenní embryo myši, které je připravené k implantaci, tj. uhnízdění do dělohy. Modře je označena jaderná DNA, symetricky zděděna od matky a otce. Ta je umístěná v desítkách buněk – patrných po obarvení aktinu (oranžově). Vlevo embryo, které obsahuje fyziologický počet mitochondrií a mtDNA, zde zeleně. Vpravo experimentálně vytvořené embryo, jehož mitochondriální genom téměř chybí; je patrné, že na velikosti embrya ani počtu buněk se tato nedostatečnost nepodepsala, navíc i toto embryo je schopno implantace. Jeho šance na další vývoj se však odvíjí od schopnosti aktivace mitochondriálního genomu, ke kterému ale dochází až po implantaci. Zdroj: Miki Shavit a kol, FASEB, 2025
Nejnovější poznatky ale ukazují, že se bez mitochondriálního genomu překvapivě obejdou také vajíčka. A pokud čekáte, že se tato indispozice rychle projeví po oplození, popř. během časného embryonálního vývoje, tak se mýlíte. Dnes už víme, že embryo se stopovým množstvím mtDNA doroste až do stádia blastocysty schopné uhnízdění v dutině děložní! Tedy vydrží dlouhých 5 dní prakticky bez exprese mitochondriálních genů. Až po uhnízdění blastocysty můžeme hovořit o jakési aktivaci mitochondriálního genomu, kdy embryo hraje vabank s osudem ve stylu „vše nebo nic“. Když se povede z toho nepatrného množství mitochondriálního genomu vykřesat větší populaci molekul mtDNA a exprimovat dostatek RNA a proteinů, embryo bere vše a vyvíjí se bez handicapu. Pokud se tenhle kousek nepovede, embryo zaniká a nevyvíjí se vůbec.
##seznam_reklama##
Rozdíl mezi mitochondriemi spermie a vajíčka je vskutku paradoxní. Spermie s minimem mitochondrií zůstává pohyblivá hodiny až několik dní. Vajíčko s obrovským množstvím mitochondrií je vlastně nepotřebuje, nebo alespoň ne v takovém nadbytku. Vajíčku pomalu začínáme rozumět – respirace mitochondrií je minimální, aby ochránilo mtDNA ukrytou v každé z nich před škodlivými kyslíkovými radikály – ty jsou rizikem mutací. Vždyť vajíčko musí předat mitochondriální genom v nejvyšší možné kvalitě potomkovi. Překvapivé ale je, že nadbytek mitochondrií a zejména počet mtDNA molekul je v mnohem větším nadbytku, než jsme doposud předpokládali a vystačí si se zanedbatelným množstvím. Stejně tak je zarážející, že se embrya vyvíjí do stádií, která jsme považovali za plně závislá na vysoké mitochondriální aktivitě. To nás vede k několika závěrům…
Hodnotit vajíčka či časná embrya podle množství mitochondrií a mtDNA by bylo velmi krátkozraké. Přesto inklinujeme k zavádějícímu předpokladu „čím více tím lépe“, a to zejména v tzv. asistované reprodukci. Embrya vytvořená in vitro lze před transferem do těla matky hodnotit, ale kvantita mitochondriálního genomu zcela jistě neodpovídá jejich morfologii. Zkrátka, i hezká embrya mohou mít jen malé množství mitochondrií a naopak. Na druhou stranu, kvalita mitochondriálních genů, resp. výskyt mutací, stojí za vysokou pozornost! Lze totiž očekávat, že pokud se mutace v embryu po uhnízdění do dělohy matky rozšíří, embryo přežije, ale později může být rizikem mitochondriální nemoci s pozdějšími projevy. Anebo embryo nezvládne aktivovat svůj mitochondriální genom a zaniká - tento zánik se projevuje tzv. časnou embryonální ztrátou způsobenou poruchou implantace. Není divu, že tyto ztráty jsou často bez známé příčiny, a tedy jen těžko léčitelné kauzálně. Nové poznatky a další pozornost věnovaná mitochondriím ale může v reprodukci hodně změnit k lepšímu.
Původní práce: