Problém zaplňování atomových orbitalů je klíčem k pochopení násobnosti vazby. V atomech existuje několik typů orbitalů, s, p, d a f, které mohou být zaplněny 2, 6, 10 a 14 elektrony. Neúplně zaplněný orbital vždy obsahuje alespoň jeden nespárovaný (elektron nemá svého partnera s opačným spinem) elektron. Tyto nespárované elektrony se pak mohou účastnit chemické vazby. V orbitalech s se tedy může vyskytovat maximáně jeden nespárovaný elektron, kdežto orbitaly p mohou obsahovat až tři nespárované elektrony. Jinými slovy elektrony z orbitalů s mohou tvořit pouze jednoduché vazby, při účasti orbitalů p je možné tvořit i vazby dvojné a trojné. Pokud bychom tedy měli uvažovat o vazbách s násobností větší než tři museli bychom zapojit i orbitaly d. Je sice možné namítnout, že čtyři nespárované elektrony bychom mohli dostat i v případě neúplně zaplněných orbitalů p (tři nespárované elektrony) a s (jeden nespárovaný elektron), ale tuto situaci kvantová fyzika nepřipouští. Všechny prvky, které obsahují tři nespárované elektrony v orbitalech p (dusík, fosfor, arsen, antimon a bismut) mají zcela zaplněny orbitaly s. Nejlehčím prvkem, který by mohl teoreticky vytvořit vícenásobnou vazbu je chrom. V jeho částečně zaplněném orbitalu d se nachází pět nespárovaných elektronů.
Teoreticky tedy mohou existovat nejen čtverné, ale dokonce i paterné a šesterné vazby, protože existují elektronové konfigurace, které by mohly tyto multiplicity umožnit. Dostatečný počet elektronů ale není vše. Tvar a orientace orbitalů hraje neméně důležitou roli, protože elektrony v orbitalech musí být sdíleny oběma atomy. Jinak vazba nemůže vzniknout. Tento „topologický“ argument byl dlouho brán jako jasná překážka pro existenci stabilní vazby s multiplicitou větší než tři. O překvapení se ale postaral v roce 1965 Albert Cotton. Ten syntetizoval sloučeninu K2(Re2 Cl8).2H2O, u které prokázal, že mezi atomy rhenia existuje čtverná vazba. Od té doby již bylo charakterizováno několik set sloučenin se čtvernou vazbou stabilních nejen při pokojové teplotě, ale i při teplotách přes 100O C. I když se tedy o čtverných vazbách ve škole neučí, není to nic mimořádně exotického. O další rozruch se ale nedávno postarala skupina Philipa Powera z Texasu, která v roce 2005 oznámila syntézu sloučeniny chromu, RCr-CrR (R je ligand 2,6,-[(2,6-diisopropyl)fenyl]fenyl), kde Cr-Cr vazba vykazuje jasné známky paterné vazby. Navíc sloučenina je stabilní až do teploty 200O C což ukazuje na značnou pevnost této vazby. Další zajímavostí této sloučeniny je, že vazby by se mělo účastnit pět elektronů z orbitalu d a jeden z orbitalu s. Formálně je tedy multiplicita vazby dokonce šest. Výpočty ale ukázaly, že díky orientaci orbitalů se některé elektrony účastní vazby jen částečně a vazba je skutečně paterná. Přítomnost ligandu je klíčová, protože „deformuje“ orbitaly atomu chromu tak, aby mohla vzniknout stabilní paterná vazba. Snad ještě větším „exotem“ je molekula U
Pokud se někomu zdá i paterná vazba málo exotická, pak vězte, že existuje i vazba šesterná. V důsledku velmi komplikované struktury vazebných orbitalů jsou tyto vazby ale extrémně slabé a molekuly se šesternou vazbou byly tudíž pozorovány jen v plynné fázi za velmi nízkých teplot. Vyšší teplota či srážky s jinými molekulami v kapalné fázi vedou k zániku těchto vazeb. Šesterná vazba byla prokázána v molekule Mo2. Molybden má podobně jako chrom k dispozici šest vazebných elektronů a za velmi nízkých teplot tvoří Mo-Mo vazbu skutečně všech dvanáct elektronů. Další potenciální „šesterák“ je molekula W2, kde se pro změnu opakuje situace uranu. Wolfram má pouze čtyři nespárované elektrony v orbitalu d, další dva poskytuje rozpárování elektronů ze zaplněného orbitalu s. U šesterných vazeb cesta končí. Současné znalosti periodické tabulky říkají, že elektronové konfigurace schopné sedmerných či „více-merních“ vazeb se nevyskytují.
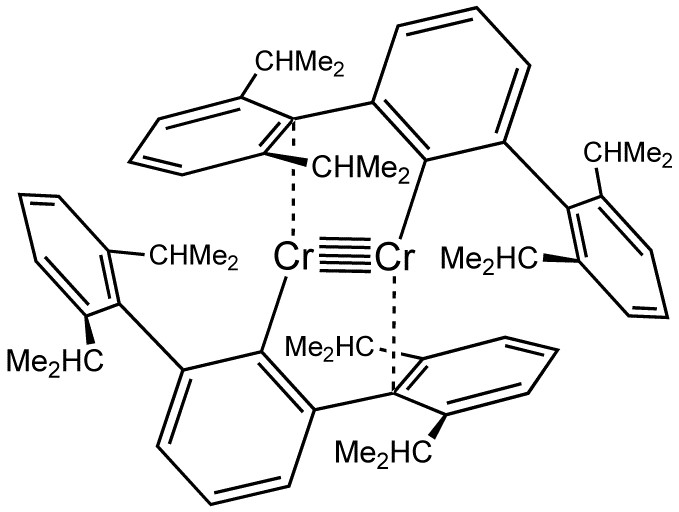
Struktura sloučeniny chromu s paternou vazbou, [CrC6H3-2,6-(C6H4-2,6-(CHMe2)2)2]2
Diskuze:
Me
Michal Douša,2018-04-22 00:05:46
Jo a ještě chci vědět, co je "Me" v tom vzorci a modelu molekuly jak chrom tvoří paternou vazbu. "Me" opravdu není značka žádného prvku. Konkrétně jsou to skupiny CHMe a já opravdu nevím co "Me" je a do periodické soustavy prvků jsem se koukal...
test
test,2008-03-17 18:16:32
 O2
 ||
O2= Os = O2
 ||
 O2
vazba vs. mocnost
autor,2007-09-25 18:04:40
Rpozdil je v tom, ze vazba definuje spojeni dvou atomu. V pripade hypoteticke osmerne vazby by vsechny vazebne elektrony musely byt sdileny pouze a jen dvema atomy Os. To nemuze nastat, protoze veschny vazebne orbitaly "nemiri" stejnym smerem. Je to totez jako u uhliku - v hybridizaci sp3 ma ctyri vazebne elektrony takze muze vzniknout molekula CH4. Nikdy ale nevznikne molekula C-ctverna-C, protoze vazebne orbitaly nemiri proti sobe.
nasobnost vs mocnost
Josef Skramusky,2007-09-24 23:44:38
V pripade nasobnosti jde o to kolik "carek" je mezi dvema atomy - tj. v pripade molekuly vody H-O-H tu mame dve jednoduche vazby, v pripade molekuly kysliku O=O jednu dvojitou.
kysličník osmičelý
PiláT,2007-09-24 12:29:24
Zdůvodněné je to pěkně, ale já jsem asi něco nepochopil. Běžně se vyskytují (t.j. učí se o nich ve škole) osmimocné sloučeniny, např. OsO4. Potom ale nechápu v čem je to jiný případ. Děkuji za odpověď.
Mocnost neni násobnost
Kvakor,2007-09-24 12:33:01
Mocnost prvku neni totéž násobnost vazby. Oxid osmičely je sice osmimocný, ale jednotlivé vazby s atomy kyslíku jsou jenom dvojité.
ještě OsO4
PiláT,2007-09-24 21:51:10
Děkuji. Já jsem to tak trochu tušil. Ale pokud se na věc dívám z pohledu atomu osmia, tak nevím jaký je rozdíl mezi Os-osmivazba-Os a (následuje pokus o TextArt):
O2
||
O2= Os = O2
||
O2 (konec TextArtu)
Mám namysli párování elektronů v jednotlivých orbitalech, takže možná nevím dál.
TextArt
PiláT,2007-09-24 21:54:33
Pokus o TextArt v příspěvku nevyšel, škoda. "O2-dvojná vazba" má mířit na "Os". Při vkládání příspěvku to sežere mezery na začátku řádku. Zkuste si to prosím představit posunuté
nonbreakspace
xxsx,2007-10-10 19:09:39
mozna bude fungovat & n b s p ;
hmm
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce



