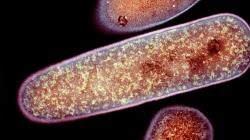
Do souvislosti se sekundárními infekcemi se dostal kmen bakterií Clostridioides difficile, vyskytující se především v rozvinutých zemích. Řadíme ho mezi anaerobní gram- pozitivní bakterie, které osidlují tlusté střevo. Hlavní ohroženou skupinou jsou lidé starší 65 let, kteří užívají velké dávky antibiotik. Ti následně trpí narušením ochranné střevní mikroflóry, která se nemá jak bránit útoku C. difficile. U takovýchto pacientů dochází k přemnožení patogenu. Bakterie vylučují do svého okolí dva toxiny TcdA a TcdB (toxin clostridium difficile A a B). Ty narušují propustnost střevní stěny, navozují zánět, který pacienty ohrožuje. Navíc se ukázalo, že C. difficile je celkem rezistentní vůči antibiotikům a ročně v USA zabije na 30 000 pacientů.
C. difficile se přenáší orálně-fekální cestou, v nemocnicích se s ním často setkáme na toaletách, umývárnách nebo třeba na rektálních teploměrech. Takto znečištěné předměty pak slouží jako rezervoáry bakterií. Clostridioides navíc vytváří infekční spóry, které jsou odolné vůči vysokým teplotám a běžným dezinfekcím na bázi alkoholu. Proto je velmi obtížné se jich zbavit. Nakazit se ale můžete prakticky kdekoli, ať už u sebe doma nebo prací na zahradě, C. difficile se nachází téměř všude.
Úlevu by pacientům mohly přinést transplantace mikrobiomu. Jedná se o přenos stolice (obsahující plno „dobrých“ bakterií a živin) v nativní či zpracované formě od dárce k příjemci. Tato kůra je prováděna za účelem léčby příjemce. Již v minulosti bylo experimentálně dokázáno, že významně pomáhají přemoci nezdolatelnou infekci C. difficile. Popsána byla účinnost přes 90 %, tedy zhruba trojnásobná oproti antibiotikům vankomycinu či fidaxomicinu. Avšak transplantace fekálií i v roce 2020 patří spíše do experimentální sféry, než do běžné praxe. Jak se ukazuje, i když jsou nadějné, nejsou zcela bez rizika. Přes velkou dávku opatrnosti, mohou být do příjemců spolu s přenosem obsahu střeva od dárce, vpraveny také patogeny. Ty představují už pro tak oslabené pacienty velké riziko, proto se léčba zánětů způsobených C. difficile fekální transplantací zatím rutinně nepoužívá.
Co se naopak proti C. difficile používá, jsou antibiotika. Ano, opět antibiotika. I když víme, že na C. difficile moc nefungují a mohou napáchat další škody, často po nich lékaři sahají. Dokonce se po přeléčení antibiotiky infekce v jednom ze šesti případů vrací v ještě větší síle! Dobrou alternativou je k léčbě použít imunoglobuliny neboli monoklonální protilátky. Ty vznikají po kontaktu lidských B-lymfocytů s antigenním epitopem na povrchu bakterie. Zjednodušeně se dá říct, že imunoglobuliny slouží k neutralizaci toxinů, kterými C. difficile škodí. Nevýhodou monoklonálních protilátek je jejich podání intravenózně (injekcí do žíly). Protilátky tak musí projít krevním řečištěm, než se dostanou do střeva, kde mohou začít účinkovat. Jak se ale z krve do střeva dostanou? Přesný mechanismus průniku neznáme. Spekuluje se, že k němu dochází v důsledku poškození propustnosti střevní stěny vyvolané toxiny patogenů.
S ještě lepší alternativou léčby přišli v americkém Marylandu. Zde pracuje imunolog čínského původu, profesor Hanping Feng. Ten se rozhodl zatočit s vysokou výrobní cenou protilátek podávaných pacientům intravenózně. A tak se svými spolupracovníky vzal kvasinku a uzpůsobil ji k obrazu svému. Nebyla to obyčejná kvasinka Saccharomyces cerevisiae, kterou známe z piva, ale speciální probiotický kmen Saccharomyces boulardii. Nově upravená kvasinka, nejen že příznivě ovlivňuje zdraví konzumenta upravením střevní mikroflóry, ale zároveň umí do okolí vypouštět antitoxiny proti TcdA aTcdB.
Testy, které byly zatím provedeny na myších, vypadají slibně. Nejprve byly myším vpraveny do břicha TcdA s TcdB, následovalo podání připraveného antitoxinu. Všechna zvířata, která dostala antitoxin, přežila. Druhý test byl navržen tak, aby co nejvíce připomínal reálnou situaci pacientů. Myším byla nejprve antibiotiky vybita střevní mikroflóra a následně byly infikovány spórami. Zvířata pak v krmivu dostávala ony probiotické kvasinky. Jedna skupina myší ale dostávala probiotika nejen po infikaci, ale i tři dny před ní. A výsledek? Všechny myši, které dostávaly probiotika s předstihem infekci přežily. Z druhé skupiny zbylo jen 40 % jedinců.
Hned po tom, co se novinka rozkřikla po Státech, přišly první ohlasy. Strukturní bioložka Borden Lacy, která na Vanderbiltově univerzitě v Tennessee zkoumá mechanismy působení toxinů C. difficile, celou věc okomentovala slovy: “Je to úžasné. To, co nejvíce potřebujeme, je získat čas, aby pacienti mohli ve zdraví obnovit svůj střevní mikrobiom a měli sílu vypořádat se s toxiny, které by je mohly ohrozit.“
A původce revoluční myšlenky? Profesor Feng založil firmu, která bude produkovat upravené kvasinky. Ty by následně měly být použity pro klinické testování. Dále bude na Americkém Úřadu pro kontrolu potravin a léčiv, aby posoudil rizika a výhody použití geneticky modifikovaného organismu pro terapeutické účely. Pokud vše proběhne hladce, budou modifikované kvasinky vůbec prvním lékem svého druhu na světě. Jak sám profesor říká, celé jeho snažení je během na dlouhou trať. Nyní hledá investory, kteří jeho firmu podpoří, a doufá, že do tří let by mohly práce na klinickém testování započít.
Zdroje
https://www.sciencemag.org/news/2020/10/antibody-producing-yeast-vanquishes-deadly-gut-infection-mice
DOI: 10.1126/scitranslmed.aax4905
https://www.wikiskripta.eu/w/Monoklon%C3%A1ln%C3%AD_protil%C3%A1tka
https://www.wikiskripta.eu/w/Fek%C3%A1ln%C3%AD_transplantace
Koktejl fekálních bakterií proti nezdolným klostridiím
Autor: Stanislav Mihulka (23.01.2013)
Budeme místo konopí pěstovat kvasinky?
Autor: Tereza Prokopová (08.07.2020)
Diskuze:
Rutina
František Drozen,2020-11-13 18:02:37
Vím že to bude znít divně, ale nebylo by možné před podání silných antibiotik, odebrat stolici? Stejně jako při autotransfuzi?
Objev možná na Nobelovu cenu
Pavel Trávník,2020-11-10 18:45:54
Je to skvělá myšlenka s vysokým realizačním potenciálem. Pravděpodobně bude tato metoda využitelná i u jiných onemocnění gastrointestinálního traktu, infekčních, autoimunitních ... Jen je třeba kvasinky naprogramovat na potřebné syntézy. Konec konců by se mohly uplatnit i při výrobě látek vstřebávaných z gastrointestinálního traktu do krevního oběhu, nejen k lokální léčbě ...
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce