Když se dostaneme na úroveň molekul a atomů, tak se obvykle všechno odehrává velice rychle. Proto je velice obtížné sledovat, co se během chemických reakcí s molekulami vlastně děje. Tým z Harvardu vymyslel způsob, jak chemickou reakci razantně zpomalit, aby ji bylo možné důkladně pozorovat. Jejich výzkum publikoval časopis Science.
Kang-Kuen Ni a její kolegové na to šli vlastně docela jednoduše, i když samotné provedení bylo samozřejmě velice náročné. Před pozorováním samotné reakce zmrazili molekuly i jejich prostředí na extrémně nízkou teplotu. Pak mohli uskutečnit chemickou reakci v doposud nejchladnějších podmínkách a poprvé detailně zobrazit v přímém přenosu, jak si dvě molekuly v této reakci vyměňují atomy.
Absolutní nula, tj. – 273,15 °C je považována za nejnižší možnou teplotu vůbec. Za této teploty absolutně ustane veškerý pohyb a molekuly i atomy „zkamení“. Tým Harvardu během experimentu zmrazil molekuly dotyčné chemické reakce na několik miliontin stupně nad absolutní nulu. Dosáhli teploty 500 nanokelvinů. To je nižší teplota, než jaká se podle našich zkušeností přirozeně vyskytuje kdekoliv ve vesmíru. Kupříkladu nejchladnější místa mezihvězdného prostoru mají teplotu kolem 3 kelvinů, tj. 3 miliardy nanokelvinů. Zároveň nešlo o teplotní rekord, protože v zařízení Cold Atom Lab na palubě Mezinárodní vesmírné stanice dosáhli teploty pouhých 100 nanokelvinů, čili ještě pětkrát nižší.
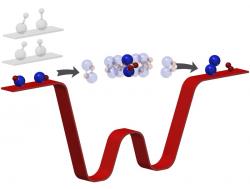
Ni a její tým pracovali s plynem tvořeným molekulami z atomů draslíku a rubidia (KRb). Když se tyto dvě molekuly setkají, tak si navzájem prohodí atomy a vytvoří dvě nové molekuly. Jednu ze dvou atomů draslíku a druhou ze dvou atomů rubidia (KK a RbRb). Za normálních okolností tato reakce proběhne tak nesmírně rychle, že ani nejvýkonnější přístroje dneška nedovedou zachytit samotný průběh této reakce. V jednu chvíli existují dvě molekuly KRb, a pak, jako kouzlem, se najednou objeví molekuly KK a Rb.
Brutální zmrazení pomohlo. Nejchladnější chemická reakce světa zpomalila svůj průběh natolik, že vědci byli schopni sledovat, co se vlastně děje. Zjistili, že v průběhu této reakce dočasně vznikne jediná molekula složená ze všech čtyř zúčastněných atomů. Pak sledovali, jak se rozvolňují původní chemické vazby mezi atomy, a poté vznikají vazby nové.
S tímto postupem teď bude možné studovat chemické reakce mnohem detailněji než doposud. A nejde jen o pozorování. Dramaticky zpomalený průběh chemické reakce umožní, aby vědci mohli do reakce velmi přesně zasáhnout. To otevírá zcela nové možnosti pro řadu rozmanitých aplikací. Podobné zákroky by se mohly uplatnit ve výzkumu a vývoji nových léků, materiálů pro energetiku nebo třeba pro rozličné produkty každodenní spotřeby.
Video: ICAP 2018 - Kang Kuen Ni
Literatura
Harvard University 28. 11. 2019, Science 366: 1111–1115.
První zřetelné snímky molekuly během chemické reakce
Autor: Stanislav Mihulka (03.06.2013)
Pozorování vzniku chemické vazby v přímém přenosu
Autor: Stanislav Mihulka (14.02.2015)
Zázračná mašina na syntézu malých organických molekul
Autor: Stanislav Mihulka (17.03.2015)
Diskuze:
V tomto článku je víc divných věcí.
Jiří Pospíšil,2019-12-08 05:57:58
Mě se jeví například i věta: "Před pozorováním samotné reakce zmrazili molekuly i jejich prostředí na extrémně nízkou teplotu." velmi podivná. To jde i odděleně?
Nějak mi to nejde dohromady s definicí teploty.
Mimo témy - jazyk
Pavel Šimon9,2019-12-04 07:32:32
Keď tento obrat "ještě pětkrát nižší" použivajú bežný novinári, tak len mávnem rukou. Ale tu mi to dosť prekáža.
Nedá sa napísať "jedna pätina"? Alebo je takéto písanie v poriadku?
Navyše tu sa aspoň limitne blížime k O K, takže iný zmysel ako 500 nK a 100 nK to nemá. Ale ak sa napr. vyjadrujem o teplote - 1 °C. Potom "ještě pětkrát nižší" je aká hodnota? -5 °C alebo čo? A dokonca pi +1 °C už ani netuším aká je teda "ještě pětkrát nižší" teplota.
Re: Mimo témy - jazyk
Vojta Ondříček,2019-12-04 19:43:25
Ano, máte naprostou pravdu.
Pětkrát vyšší, dává smysl : desetipatrový dům, je pětkrát vyšší, než dvoupatrový.
Oproti tomu je pětkrát menší budova, než ta dvoupatrová je těžce představitelná ... leda, že by měla osmipatrový sklep. Nebo?
Ostatně, v dětství jsem hloubal nad problémem, jak to, že "jednou tak velký" je stejně velký jako "dvakrát tak velký". Dnes, ve zralém věku, jsem se s tím smířil a snažím se takovým záhadám vyhnout. Pakliže na mne však někdo takovým způsobem zaútočí, tak se snažím dopátrat pravdy křížovým výslechem.
Výraz "nicméně" je podobný jazykový oříšek, který asi není snadné rozlousknout. To "nicméně" by mělo znamenat, že je to stejné, tedy o nic menší. Nebo?
Vážnějším jazykovým tajemnostem, jako třebas výrazům "Hala-bala", nebo matematické záhadě "o sto šest", se raděj úplně vyhýbám.
Re: Mimo témy - jazyk
Lubomir Hnedkovsky,2019-12-06 05:32:07
x-krat nizsi/vyssi lze pouzit jen u teploty absolutni (vyjadrene v Kelvinech). U Celsiovy stupnice to nejde, protoze 0°C je posunuta vuci absolutni nule o 273.15K.
Neni to nic jineho nez prima umera, ktera plati pro zavislosti jdouci pocatkem.
Takze to co je v textu clanku je v poradku.
p.s.: petkrat nizsi teplota nez -1°C by byla (272.15 K)/5 = 54.43 K = -218.72°C
Re: Re: Mimo témy - jazyk
Vojta Ondříček,2019-12-06 14:01:33
Díky za vysvětlení.
Přesto bych použil spíš větný obrat "snížili teplotu na pětinu výchozí hodnoty", to jest z hodnoty 500nK na pětinu, tedy na 100nK.
500 x 5 = 2500
500 x 1/5 = 500 / 5 = 100
Možná to "pětinásobné snížení" některé lidi netahá tolik za uši (za neurony), jako některé pedanty.
Endotermická reakce
Pavel Matějka,2019-12-03 21:03:20
Dobrý den, opravte mě, jestli se mýlím, ale mnoho chemických reakcí je endotermických, tzn. během reakce spotřebovávají tepelnou energii. Jak ale můžeme dodat do tak podchlazeného systému energii, abychom teplotu nezvýšili a nezrychlili děj? I některé exotermické děje potřebují pro spuštění iniciační energii, což jsme zase u stejného problému...
Re: Endotermická reakce
Vladimír Bzdušek,2019-12-03 21:28:38
Doporučujem vyskúšať reakciu vodík + fluór. Prebieha výbuchom už pri teplote skvapalneného vodíka.
Re: Endotermická reakce
Florian Stanislav,2019-12-03 23:13:57
Molekuly nemají stejnou rychlost, ale Gaussovo rozdělení, nejvíc kolem střední kvadratické rychlosti. Energie uvolněná reakcí několika rychlých molekul může tím uvolněnou energií pomoci nastartovat ostatní.
Článek : "Za normálních okolností tato reakce proběhne tak nesmírně rychle"
Takže je předpoklad, že se jedná o reakci exotermickou. Typická endotermická reakce N2 + O2 za normální teploty prakticky neprobíhá, za vyšší teploty (ve spalovacích motorech) ano.
Obrázek v článku ukazuje to, co se (kdysi) nazývalo reakční koordináta. Jenomže červená páska průběhu by musela být na konci pro reakci exotermickou níž, jak na začátku.
Re: Re: Endotermická reakce
Adam Wich,2019-12-17 14:31:53
Jenom drobná technická: u absolutní nuly nemůžeme mluvit o Gaussově rozložení ale bude to asi chí kvadrát. Praktický dopad to bude mít v tom, kolik těch rychlých molekul tam může statisticky být, ale ne v tom, že tam jsou.
Re: Endotermická reakce
Lubomir Hnedkovsky,2019-12-05 05:17:29
V pripade endotermicke reakce jsou dve moznosti
1) Izotermni prubeh : Nutne reakcni teplo se doda zvenci. Toto teplo je "spotrebovano" chemickou reakci & tudiz nevede ke zvyseni teploty reakcni smesi.
2) Adiabaticky prubeh : Reakce je od okoli izolovana & reakcni smes si potrebne teplo doda sama tim, ze se ochladi.
Aktivacni enegie je neco trochu jineho. Nizka teplota pouze snizuje pocet molekul (atomu), ktere maji dostatecnou energii, aby prekonaly aktivacni barieru. To je dusledek toho, ze pri dane teplote ne vsechny reagujici molekuly (atomy) maji stejnou kinetickou energii, ale ta podleha statisticke distribuci (Boltzmann). To je presne ten duvod, proc nizka teplota snizuje rychlost reakce.
Re: Re: Endotermická reakce
Florian Stanislav,2019-12-05 14:47:28
1) No, v případě endotermické reakce jsou možnosti tři. Izotermický děj, adiabatický děj nebo ani jeden z nich, což rozumně musí nastat. Důvod proč by se směs měla chovat přesně adiabaticky (bez tepelné výměny s okolím) nebo přesně izotermicky (proběhne při konstantní teplotě) by mohl být leda v tom, že se nám stavové veličiny budou líp počítat.
https://cs.wikipedia.org/wiki/Endotermick%C3%A1_reakce
"Endotermické (endotermní) reakce jsou takové, při nichž je spotřebováváno teplo. Pro proběhnutí reakce je nutné ho dodávat,[1] jestliže není dodané odebere si ho z okolního prostředí (pokud by to nestačilo reakce samozřejmě neproběhne jak má nebo vůbec.). Potřebné teplo je odebráno z bezprostředního okolí. "
Přeloženo do češtiny : teplo se musí dodat z OKOLÍ, nebo ze OKOLÍ odebere (pokud to lze) a to okolí se ochladí.
2) Představě, že plyn si adiabaticky (to je bez výměny tepla z okolí) odebere sám sobě energii a pomocí této energie proběhne endotermická reakce (opět teplo spotřebovávající), tomu nerozumím.
Ano, aktivační energie je něco jiného a molekuly nemají stejnou rychlost pro danou teplotu, psal jsem to. Izotermický děj a adiabatický děj jsou i dle Vás něco jiného, takže nevím, co se tím řešilo.
Re: Re: Re: Endotermická reakce
Lubomir Hnedkovsky,2019-12-06 04:28:30
ad 2) Lze si to predstavit jako dva hypoteticke kroky. Reaktanty nejdrive ochladim tim, ze teplo odvedu do nejakeho zasobniku. Spustim reakci & teplo ze zasobniku do reakce "vratim", aby se tim pokryly energeticke potreby reakce. Cili ten druhy krok je jiz izotermni, ale pri nizsi teplote.
Entalpie i entropie jsou stavove veliciny, takze je uplne jedno, ze cesta od reaktantu k produktum vede pres hypoteticke stavy.
Na to existuje cela rada hezkych pokusu, napriklad rozpousteni KNO3 ve vode. Teplota citelne poklesne, protoze disociace KNO3 je endotermicka. I kdyz se tento pokus provede v tepelne neizolovane nadobce, porad je zde velky pokles teploty, protoze prisun tepla z okoli potrebuje urcity cas (jinymi slovy, reakce je rychlejsi nez tepelna vymena).
p.s.: lepsi nez 'nebo ani jeden z nich' je 'nebo kombinace obou'. do jake miry bude skutecny proces adiabaticky zalezi na kvalite tepelne izolace.
Re: Re: Re: Re: Endotermická reakce
Lubomir Hnedkovsky,2019-12-06 04:34:07
Jeste dodatek : aktivacni energie se absolutne nijak nepodili na energeticke bilanci reakce; ovlivnuje pouze kinetiku.
Re: Re: Re: Re: Endotermická reakce
Lubomir Hnedkovsky,2019-12-06 05:19:42
Jeste jeden dodatek : u zmineneho KNO3 je pokles teploty pri rozpousteni az 15C.
Re: Re: Re: Re: Re: Endotermická reakce
Jiri Naxera,2019-12-06 13:31:44
Nešlo by to vysvětlit i na mikroskopické úrovni tak, že reagující molekuly mohou spotřebovat část kinetické energie na reakci, takže produkty mají nižší střední rychlost ~= teplotu, což se poměrně rychle během pár srážek srovná s molekulami okolo, takže výsledkem je snížení teploty roztoku a/nebo plynu?
Re: Re: Re: Re: Re: Re: Endotermická reakce
Lubomir Hnedkovsky,2019-12-06 17:16:07
To je presne ono. Rychle molekuly zreaguji (pomale nemohou, protoze neprekonaji aktivacni barieru) a nahradi je pomalejsi molekuly produktu.
Re: Re: Re: Re: Re: Endotermická reakce
Florian Stanislav,2019-12-06 18:26:49
Těžko si lze představit horší příklad na endotermickou reakci jak rozpouštění KNO3 ve vodě. Změny skupenství (i tání ledu ve vodě se spotřebuje energie z okolí) jsou děje fyzikální. Chemický děj je takový, který vede k novým sloučeninám. Rozpouštění KNO3 - stále máme dusičnan draselný, i když ionty jsou solvatované vodou. Článek je o plynech - reagují molekuly K2 a Rb2.
aše hypotetické akce s přehazováním energie uvnitř plynu nefungují.
Příklad : ve vzduchu je N2 + O2 a nereagují. Reakce je silně endotermická 180 kJ/mol
O2 + N2 → 2 NO H(o)298 = + 180,58 kJ
Aktivační energie je vysoká, trojná vazba dusíku je stálá. Aktivační energie neovlivní energetickou bilanci, to máte pravdu, ale rozhoduje o tom, zda a jak rychle bude reakce probíhat, jaká se ustaví rovnováha výchozí látky produkty.
Prostě ve vzduchu se neděje nic, rovnováha se posune kolem 1000°C na stranu endotermické reakce. Jmenuje se to zobecnění zákona akce a reakce pro chemické děje. A to vzduch směs je izotermní (má stejnou teplotu) a tudíž i adiabatická (nemá si co s čímsi vyměňovat teplo, když není teplotní spád).
Takže závěr : děje izotermní, adiabatické a jakési vyměňování energie a schovávání na později - nemá to s endotermickým dějem nic rozumného společné.
Re: Re: Re: Re: Re: Re: Endotermická reakce
Lubomir Hnedkovsky,2019-12-09 07:42:41
Obavam se, ze vam ted moc nerozumim.
Rozpousteni KNO3 neni fyzikalni dej, je to chemicka reakce se vsim vsudy (zanikaji pri ni iontove vazby v pevnem KNO3, vznikaji volne solvatovane ionty). Reakce je endotermni.
(Chemicka reakce je dej, pri kterem zanikaji/vznikaji vazby, reakcni teplo je vysledna bilance vazebnych energii)
Tomu zbytku rozumim jeste mene, respektive, nevim, co tim chcete rict. Nicmene jednu vec bych vam opravil. Aktivacni enegie rozhodne nema vliv na termodynamickou rovnovahu reakce. Rovnovahu ovlivnuje Gibbsova energie, ktera ma entalpicky & entropicky prispevek (ΔG = ΔH - TΔS a ln K = -ΔG/RT). Aktivacni energie ovlivnuje toliko kinetiku.
No a pokud jde o adiabaticky endotermni dej, tak jelikoz potrebne teplo nemuze prijit zvnejsku, musi prijit zevnitr. Zakon zachovani energie. Podle me je to jasne.
Re: Re: Re: Re: Re: Re: Re: Endotermická reakce
Lubomir Hnedkovsky,2019-12-09 07:59:00
Ostatne, se to objevuje i ve vasi reakci
'Potřebné teplo je odebráno z bezprostředního okolí.
Přeloženo do češtiny : teplo se musí dodat z OKOLÍ, nebo ze OKOLÍ odebere (pokud to lze) a to okolí se ochladí. '
Pro dve reagujici (kolidujici) molekuly jsou bezprostrednim okolim dalsi pritomne molekuly. Ty ztrati cast sve kineticke energie, tudiz teplota poklesne.
Neni to nic jineho nez bilance kinetickych energii molekul. Teplota je mirou stredni kineticke energie molekul.
Re: Re: Re: Re: Re: Re: Re: Re: Endotermická reakce
Florian Stanislav,2019-12-09 20:57:01
No, každopádně rozpouštění KNO3 ve vodě je na hony vzdáleno reakci molekul K2 + Rb2 v plynném stavu, takže jestli je solvatace chemická reakce nebo není, je vcelku pro náš případ jedno.
1) Podle Vás se molekuly plynu samy zorganizují tak, že část se zahřeje (a reaguje endotermicky) a odebre teplo z okolního plynu, které se ochladí.
To odporuje kinetické teorii plynů. Třeba molekuly dusíku za normálních podmínek mají střední volnou dráhu 1E-7 m (desetina mikrometru) a pohybují se stř. kvadr. rychlostí asi 500 m/s. To znamená srážku každých asi 2E-10 s. Takže Váše teoreticky pracně vytvořená ANOMÁLIE SE V PŘÍSTÍ MIKLIARDTINĚ SEKUNDY ZASE ROZLETÍ na všechny strany a rozložení rychlostí (a tedy i teploty) bude podle Bolzmanova rozdělení a střední kvadratické rychlosti atd.
2) Stále jste nereagoval na to, proč tedy N2 + O2 za normální teploty nereagují, když se mohou samy zahřát a reagovat endotermicky a okolní molekuly plynu ochladit.
3)Také jsem psal, že nevím, proč by měl být děj adiabatický a izotermní. Nicméně , o když vzduch jako směs N2 + O2 je izotermní ( stejná teplota) a adiabatický (nemá si co s čím vyměňovat teplo, když je teplota stálá). A NIC. REAKCE NEPROBÍHÁ.
Píšete to opět:"No a pokud jde o adiabaticky endotermni dej, tak jelikoz potrebne teplo nemuze prijit zvnejsku, musi prijit zevnitr. Zakon zachovani energie. Podle me je to jasne."
Mně je zákon zachování energie jasný, dokud tu energii nedodáme zvnějšu, tak reakce endotermní reakce neoproběhne.
4) Aktivační energie se snižuje katalyzátorem.
Reakce proběhne za nižší teploty, kdy je termodynamická rovnováha jiná.
Jiný je i poměr výchozích látek a produktů. Kvůli těm produktům se katalyzátory používají.
https://cs.wikipedia.org/wiki/Katalyz%C3%A1tor
Souhlasím, že chemická rovnováha porušena není. Zvětší se rychlost reakce při nižší aktivační energii s katalyzátorem. Jinak řečeno rovnováha (rychlost reakce tam a zpět se s katalyzátore s nižší aktivační energii vyrovná dřív).
Psal jsem :"Aktivační energie neovlivní energetickou bilanci, to máte pravdu, ale rozhoduje o tom, zda a jak rychle bude reakce probíhat, jaká se ustaví rovnováha výchozí látky produkty."
Ano. Rovnováha se ustaví, až bude rychlost reakce a rychlost zpětné reakce stejná, což ale není v průběhu reakce, kdy produkty právě vznikají.
Re: Re: Re: Re: Re: Re: Re: Re: Re: Endotermická reakce
Lubomir Hnedkovsky,2019-12-11 04:36:09
Uh. Prectete si prosim uplne prvni dotaz tohoto vlakna. Je o endotermickych reakcich. Disociace KNO3 je endotermni reakce. Presto probiha spontanne i bez dodani tepla z okoli. Tak jako mnoho jinych endotermnich reakci.
1) Rekl jsem to trochu jinak, ale hlavne jsem rekl, ze se jedna o proces hypoteticky. Asi jste to prehledl. To klicove je, ze entalpie je stavova velicina. Tudiz na zpusobu prechodu ze stavu jedna (reaktanty) do stavu dve (produkty) nezalezi. Urcite jste slysel o slucovaci entalpii. Slucovaci reakce jsou pro velkou radu sloucenin ryze hypoteticka, v realu vubec neexistuji.
2) Reakce N2 + O2 ma za nizke teploty vysokou kladnou Gibbosvu energii. Rovnovazna konstanta je tudiz velmi nizka. Reakce sice probiha ale v zanedbatelnem rozsahu.
3) Porad z toho vypoustite entropii. Hnaci silou reakce neni entalpie, ale Gibbsova energie. Endotermni reakce mohou probihat spontanne (bez dodani energie zvnejsku), pokud je doprovazi dostatecne vysoky narust entropie. Kouknete nekam na reakcni Gibbsovu energii, nechce se mi to cele vypisovat tady.
Jeste jednou strucne: ΔG = ΔH - TΔS. Proces je spontanni, je-li ΔG < 0.
Vsimnete si, ze pro pripad endotermniho procesu (ΔH > 0) muze ΔG nabyt zaporne hodnoty, je-li ΔS > 0. Zaroven se hodnota ΔG bude snizovat, bude-li rust teplota. Cim je ΔG kladnejsi, tim vice je rovnovaha posunuta ve prospech reaktantu. Cim je ΔG zapornejsi, tim vice je rovnovaha posunuta ve prospech produktu.
4) Neni nutne to dale rozplizavat. Aktivacni energie (& tudiz ani katalyzator) nema vliv na rovnovahu, punktum. Jaka se nakonec ustavi rovnovaha zavisi jen na rovnovazne konstante K, ktera zase zavisi na reakcni Gibbsove energii ( ln K = -ΔG/RT ).
P.S.: Pekny priklad (kdyz vam KNO3 nevoni) je reakce N2 + 3H2 -> 2NH3 (coz jsou plyny). Tato reakce je exotermni & probiha spontanne za nizke teploty. Dostatecnym zvysenim teploty je mozne reakci otocit, bude spontanne probihat rozklad amoniaku, a to i presto, ze opacna reakce je ondotermni.
Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Endotermická reakce
Florian Stanislav,2019-12-11 11:15:06
---> L.Hnedkovky
Píšete:" Disociace KNO3 je endotermni reakce. Presto probiha spontanne i bez dodani tepla z okoli. "
Humoreska. Okolí dodává teplo reakci, tím se okolí ochladí = teplo z okolí je dodáno do kádinky s rozpouštěním. Vzduch jako směs N2+ O2 je homogenní směs PLYNŮ. Není zde žádné rozhraní (molekuly se neustále mísí, snad jste četl můj příspěvek o tom, že volná dráha molekuly vzduchu je desetina mikrometru a čas mezi srážkami je řádu 1E-10 s) jako u soustavy vzduch kádinka. Molekuly vzduchu nemohou dovnitř roztoku, čili primární výměna tepla probíhá na rozhraní, ne uvnitř celé reakční směsi jako ve vzduchu. Proto se endotermická reakce N2 + O2 ve vaší HYPOTETICKÉ ANOMÁLII vůbec nerozběhne. Co dodat. Nic.
Reakce N2 + 3H2 --->2 NH3 je exotermická (delta H = -91,8 kJ/mol.
Z toho plyne především to, že s rozpouštěním KNO3 a endotermickými reakcemi nemá nic společného.
Dodáním tepla exotermické reakci se podpoří směr reakce endotermické, tady rozklad amoniaku. No a co? Obecně, je to zobecnění zákona akce a reakce.
Píšete :"Dostatecnym zvysenim teploty je mozne reakci otocit, bude spontanne probihat rozklad amoniaku, a to i presto, ze opacna reakce je endotermni."
Komentář : reakce proběhne za vysoké teploty PRÁVĚ PROTO, že je endotermní, která teplo spotřebovává- soustava reaguje proti změně, která ji vyvolala. Viz fyzikální chemie.
1) Cituji Vás:"Rekl jsem to trochu jinak, ale hlavne jsem rekl, ze se jedna o proces hypoteticky."
Takže řešíte něco hypotetticky ---> závěry hypotetické. A k čemu jsou?
2) Reakce N2+ O2 --2 NO je silně endotermická a má velkou aktivační energii vzhledem k nutnému rozkladu pevných vazeb N2. Z toho plyne, že tato endotermická reakce za nízké teploty (tedy běžné ve vzduchu) prakticky neprobíhá. Je dobře, že tvrdíte totéž, co já, takže v čem je spor?
Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Endotermická reakce
Lubomir Hnedkovsky,2019-12-12 06:25:02
> 'Humoreska. Okolí dodává teplo reakci, tím se okolí ochladí = teplo z okolí je dodáno do kádinky s rozpouštěním.'
Problem vasi humoresky je v tom, ze se ochlazuje roztok, nikoliv okoli. Az o 15C. Proc se ochlazuje?
A verte tomu nebo ne, KNO3 se vam rozpusti i Dewarove nadobe, kde pristup tepla z okoli je minimalni. Jinymi slovy, endotermni reakce muze probihat spontanne bez dodavani tepla z okoli. Takovy system proste jen snizi svou teplotu. (Kouknete na adiabatickou teplotu chemicke reakce).
>'Reakce N2 + 3H2 --->2 NH3 je exotermická (delta H = -91,8 kJ/mol.
Z toho plyne především to, že s rozpouštěním KNO3 a endotermickými reakcemi nemá nic společného.'
Reakce 2NH3 --> N2 + 3H2 je endotermicka. Presto za vyssi teploty probiha spontanne (protoze znamenko Gibbsovy energie je pri vyssi teplote zaporne). V izolovanem systemu se proste bude reakce ochlazovat.
> 'Komentář : reakce proběhne za vysoké teploty PRÁVĚ PROTO, že je endotermní, která teplo spotřebovává- soustava reaguje proti změně, která ji vyvolala. Viz fyzikální chemie.'
Pri vsi ucte, teplota a teplo neni jedno a totez. Coz znamena, ze pokud se dodavane teplo spotrebuje na [endotermni] reakci, nemuze byt zaroven vyuzito na ohrev. Prvni termodynamicky zakon.
Ad 2) Tady to mate zase spatne. Reakce N2 + O2 probiha, ale
1. kvuli vysoke aktivacni energii pomalu
2. kvuli vysoke Gibbsove energii jen v mizivem rosahu.
(neni problem tu rovnovahu spocitat az do 3000C, data k tomu mam, je to par celkem trivialnich rovnic).
Sumasumarum, hnaci silou reakce je pokles Gibbsovy energie. Druhy termodynamicky zakon.
Juknete treba sem : https://en.wikipedia.org/wiki/Gibbs_free_energy#Gibbs_free_energy_of_reactions
Abych to uzavrel, protoze to nevypada, ze bychom k necemu dokonvergovali :
1. Endotermni reakce muze probihat [spontanne] i bez dodavani energie z okoli.
2. Dodavani energie z okoli nezvysi teplotu reakce (napr. K + Rb), protoze se toto dodane teplo spotrebuje na reakci, nikoliv na ohrev.
Coz byl ostatne i puvodni dotaz v tomto vlakne.
Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Endotermická reakce
Florian Stanislav,2019-12-12 10:09:58
-->L.Hnedkovsky
1)Psal jsem :""Aktivační energie neovlivní energetickou bilanci, to máte pravdu, ale rozhoduje o tom, zda a jak rychle bude reakce probíhat, jaká se ustaví rovnováha výchozí látky produkty."
Ano. Rovnováha se ustaví, až bude rychlost reakce a rychlost zpětné reakce stejná, což ale není v průběhu reakce, kdy produkty právě vznikají."
Komentář :Není to tak špatná formulace, protože při reakci s katalyzátorem (ZA NIŽŠÍ TEPLOTY), bude aktivační energie jiná (menší), teplota jiná (stačí nižší), bude jiná i ta Vaše rovnovážná konstanta K vypočtená ze vzorce s Gibbsovou energií, protože tam dole v exponentu u e je teplota. A pořád je to aktivační energie, i když s katalyzátorem. Ten se Vám nehodil, takže jste diskuzi o aktivační energii s katalyzátorem vyloučil.
S katalyzátorem a nižší aktivační energií bude POMĚR produkty/ výchozí látky jiný, na čemž je založeno spoustu chemických výrob. Takže to není žádná fantasmagorie.
Neměl jsem na mysli rovnovážnou KONSTANTU, kde jsou rovnovážné koncentrace se součiny s exponenty produktů/součiny s exponenty rovn. konc. výchozích látek
https://cs.wikipedia.org/wiki/Rovnov%C3%A1%C5%BEn%C3%A1_konstanta
Tam platí Vaše oblíbená rovnice se vztahem ke Gibbsově energii.
2) Rozpouštění KNO3 ve vodě a diskuze jak se teplo nebere z okolí máte teoreticky vyřešno.
Teď praxe: Vezměte si trochu sněhu nebo drceného ledu + hrst soli (NaCl), vznikne chladící směs. Uvnitř místnosti nádobka přimrzne k mokrému hadru. Takže okolí nádoby se ochladí.
https://cs.wikipedia.org/wiki/Chladic%C3%AD_sm%C4%9Bsi
Ten školní pokus, co Vás tak zaujal je např. na
http://www.ises.info/old-site/index.php?s=efy&f=f42
"Do první kádinky nasypeme jemnou ledovou tříšť, do druhé tříšť smíchanou s několika lžičkami soli. Do obou zkumavek nalijeme stejné množství čisté vody, předem ochlazené na teplotu nižší než 15°C . Aktivní část teploměru ponoříme zhruba do poloviny vodního sloupce a obě zkumavky vložíme do kádinek s ledovou tříští. Odstartujeme měření a sledujeme chladnutí vody v obou zkumavkách."
Jistě uznáte, že zkumavka pomořená do chladicího roztoku není chladicí roztok, ale jeho okolí, které se ochladí.
Píšete:"A verte tomu nebo ne, KNO3 se vam rozpusti i Dewarove nadobe, kde pristup tepla z okoli je minimalni. "
No, slyšel jsem termosce, která omezuje tepelnou výměnu. Vaše superargumentce se zakládají na jednoduchém faktu. Jestliže je děj od okolí tepelně izolován (děj adiabatický U PLYNŮ), tak nedochází k výměně tepla.
Krystalická látka je vysoce uspořádaná, ionty kmitají kolem rovnovoážné polohy. V kapalině ( vodě molekuly volně kloužou po sobě = větší chaos. Dojde k tepelnému vyrovnání mezi DVĚM SOUSTAVAMI S RŮZNOU ENERGIÍ.
Článek je o reakci K2 + Rb2 jako plynů (jde o jednu soustavu = plyn, fyzikální výměna energie mezi molekulami je při srážkách v celém objemu a rychlá) při nízké teplotě. A nejspíš o reakci exotermickou, protože proběhne velmi rychle, jak je psáno. Že molekuly K2 a Rb2 mají jiný obsah chemické energie je jiná věc. To se při chemických reakcích stává ..:)
Píšte :"2. Dodavani energie z okoli nezvysi teplotu reakce (napr. K + Rb), protoze se toto dodane teplo spotrebuje na reakci, nikoliv na ohrev."
Komentář: no konečně, tak to teplo, co se z okolí nebere ( protože je dle Vaší hypotézy děj adiabatický) se z okolí bere a jmenuje se to "Dodavani energie z okoli".AC
Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Endotermická reakce
Lubomir Hnedkovsky,2019-12-12 12:36:53
Zacina se to rozplizavat a nad nekterymi vecmi nestacim kroutit hlavou :-)
Rozdelim to na dve casti
KINETIKA:
Aktivacni energie vubec nesouvisi s termodynamikou reakce. Katalyzator take ne. Snad prvni vec, ktera se o katalyzatorech uci je, ze nezvysuji vyteznost reakce. Kdyby tomu tak bylo, tak vice produktu by znamenalo vice spotrebovaneho/vygenerovaneho tepla, coz by ovlivnilo energetickou bilanci. Coz jsme snad uz - diky bohu - vyloucili.
Ze bude s katalyzatorem pomer produkty/vychozi latky vyssi plati jen do te dobe, nez reakce dospeje do rovnovahy. Coz je pochopitelne. Produkty vznikaji rychleji, takze v kazde fazi pred dosazenim rovnovahy jich bude vice nez v reakci nekatalyzovane. Ale v rovnovaze bude pomer produkty/vychozi latky naprosto stejny (za teze teploty). Kdyz fouka silny vitr, je na zemi vice jablek nez kdyz nefouka, ale az opadaji vsechna, bude jich na zemi stejne, s vetrem ci bez nej.
Pokud si muzeme dovolit diky katalyze provadet reakci pri nizsi teplote, ani to nezarucuje vice produktu. Zalezi na tom, jestli rovnovazna konstanta s teplotou roste nebo klesa. Cimz jsme zpatky u reakcniho tepla (rika se tomu Kirchhoffova veta, kdyby vas to zajimalo).
(Pozn. Synteza amoniaku je z hlediska konverze vyhodnejsi pri nizke teplote (Gibbsova energie je zaporna). Jenze je silene pomala. Pri vysoke teplote je konverze mnohem nizsi (Gibbsova energie je kladna), ale malo produktu mame velice rychle. Oproti 'hodne produktu za dlouho' davame prednost 'mene produktu hned'. TA tak se to taky dela. Pri vyssi teplote se vznikly aoniak odebere a vodik s dusikem se vrati zpatky do reaktoru).
Takze sumasumarum, aktivacni energie ci katalyza s puvodnim dotazem vubec nesouvisi. Aktivacni energie se do reakce nedodava. Nesedel by zakon zachovani energie.
Tim bych zalezitost kinetiky povazoval za vyresenou a nevidim duvod se k ni vracet.
Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Endotermická reakce
Lubomir Hnedkovsky,2019-12-12 13:32:17
Cast druha
TERMODYNAMIKA
1. zakon termodynamiky (v podstate zakon zachovani energie)
Je-li reakce exotermni & vygenerovane teplo se neodvede uplne do okoli, reakce se zahreje.
Je-li reakce endotermni & potrebne se teplo ze nedoda uplne z okoli, reakce se ochladi.
Je-li reakce exotermni & vygenerovane teplo se odvede, teplota se nezmeni (izotermni prubeh).
Je-li reakce endotermni & potrebne teplo se doda z okoli, teplota se nezmeni.
Jinak to byt nemuze, nevidim jak to zpochybnit.
2. zakon termodynamiky (o smeru procesu)
Druhy zakon rika, ze kazdy proces speje samovolne do stavu s nizsi Gibbsovou energii. Gibbsova energie ma dva prispevky, entalpicky & entropicky: ΔG = ΔH - TΔS.
Hodnota ΔG tedy zavisi na reakcni entalpii, reakcni entropii & teplote. V termodynamicke rovnovaze ΔG = 0 (uz neni zadna nizsi hodnota G, reakce nema kam pokracovat).
V pripade chemickych reakci si to lze predstavit jako provazovy most od vychozich latek k produktum. Kdyz se po nem pusti mic, skutali se z kazde strany do minima. A tam zustane. To je rovnovaha.
Jestli vam to pomuze, vezmete si do kazde ruky konec provazku. Leva ruka bude predstavovat vychozi latky, prava ruka produkty. Kdyz levou ruku snizite, minimum provazku se posune k leve ruce. To je stav, kdy Gibbsova energie produktu je vyssi, tudiz ΔG >0 & rovnovaha je posunuta smerem k vychozim latkam.
Kdyz naopak konec provazku v prave ruce date niz nez konec levy, minimum na provazku se posune smerem doprava, tedy k produktum.
Takhle ta rovnovaha funguje.*)
Z definice ΔG je patrne, ze reakce muze pokrocit v danem smeru, je-li ΔG = ΔH - TΔS < 0,
tedy ΔH < TΔS. Jinymi slovy, i endotermni reakce muze probihat, pokud kladnou entalpii "prebije" kladna entropie (spolu s teplotou). Je jedno, jestli se potrebne teplo doda zvenci & reakce probehne izotermne, nebo jestli se reakce zrealizuje adiabaticky & spotrebovane teplo ochladi reakci.
*) Rovnovazna konstanta (tedy i pomer produkty/vychozi latky) je spjata prave s Gibbsovou energii: ln K = - ΔG/RT. I bez pocitani je jasne, ze je-li ΔG > 0, je ln K < 0 & tudiz K < 1.
Je-li ΔG < 0. je ln K > 0 & K > 1.
Rovnovazna konstanta neni nic jineho nez vyjadreni pomeru produkty/vychozi latky.
Rovnovazna konstanta K zavisi na teplote (Kirchhoffov veta)
d(ln k)/dT = ΔH/RT^2 . Vyjadreno slovne to znamena, ze je-li reakce endotermni, zvysena teplota zvysuje K & tudiz i vyssi stupen premeny. Je-li reakce exotermni, vyssi teplota znamena nizsi K & tudiz i izsi vyteznost. Zcela v souladu s tzv. Le Chatelierovym principem.
ZAVER:
Je-li reakce K2 + Rb2 endotermni, nemusime delat nic. Reakce se trosku ochladi, cimz se zaroven i zpomali & to je presne to, oc experimentatorum slo. Ale i kdybycho tu reakcni entalpii dodali, nic se nestane, reakce zustane pri konstatni teplote. Dodane teplo totiz spotrebuje rakce & na ohrev reakce uz nezbyde nic.
Pokud je reakce K2 + Rb2 exotermni, je nutne vygenerovane teplo odvadet. Kdyz tak neucinime, reakcni teplo reakci ohreje & nasledne zrychli.
Jinymi slovy, pro endotermni reakci K2+Rb2 je vhodny zpusob adiabaticky (bez vymeny tepla s okolim), pro exotermni reakci je nutny zpusob izotermni (s odvodem tepla do okoli)
Howgh.
Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Re: Endotermická reakce
Florian Stanislav,2019-12-12 18:22:24
-->L.Hnedkovsky
Píšete o katalyzátorech:" Produkty vznikají rychleji, takze v kazde fazi pred dosazenim rovnovahy jich bude vice nez v reakci nekatalyzovane. Ale v rovnovaze bude pomer produkty/vychozi latky naprosto stejny (za teze teploty)"
Komentář: konečně jste pochopil , co opakovaně píšu o katalyzátorech. Poměr produkty/výchozí látky (a rovnovážná konstanta) bude jiný (chem. výroba usiluje o více produktů), protože reakce s katalyzátorem proběhne za jiné (nižší) teploty, bude vyšší výtěžnost atd.
Píšete :" Zalezi na tom, jestli rovnovazna konstanta s teplotou roste nebo klesa."
Vy předpokládáte ve své teoretické anomálii, že teplota je stejná a děj izotermický. A proč by izotermický být měl?
Píšete :"Pri vyssi teplote se vznikly amoniak odebere a vodik s dusikem se vrati zpatky do reaktoru"
Ano, odebrání produktů posune rovnováhu ve směru produktů- soustava působí proti změně, která ji vyvolala (proti poklesu konc. produktů). Takže to není o rovnováze, ale o porušování rovnováhy, čili výroba k rovnováze trvale směřuje.
Píšete ."Takze sumasumarum, aktivacni energie ci katalyza s puvodnim dotazem vubec nesouvisi. Aktivacni energie se do reakce nedodava. Nesedel by zakon zachovani energie."
Komentář : To jste první, kdo by porušil zákon zachování energie. Ten platí pro izolovanou soustavu. Takže reaktor + okolí, které dodává energii je soustava, kde zákon zachování platí. Když odhlédnu od toho, že nevím, co ten původní dotaz byl.
Píšete v druhé části :"1. zakon termodynamiky (v podstate zakon zachovani energie)
Je-li reakce exotermni & vygenerovane teplo se neodvede uplne do okoli, reakce se zahreje.
Je-li reakce endotermni & potrebne se teplo ze nedoda uplne z okoli, reakce se ochladi.
Je-li reakce exotermni & vygenerovane teplo se odvede, teplota se nezmeni (izotermni prubeh).
Je-li reakce endotermni & potrebne teplo se doda z okoli, teplota se nezmeni."
Takže šup a neřešíme už děj adiabatický, teplo se vyměńuje jedna radost a platí zákon zachování energie.
Závěr máte taky hezký:
a)Když je reakce exotermická, tak se soustava zahřeje.
b)Když je reakce endotermická, tak se ochladí. A kdybychom náhodou dodali přesně množství energie, tak se neochladí.
Přeji hezké svátky a pohodu u výpočtů s Gibbsovou energii.
Re: Re: Re: Re: Re: Re: Endotermická reakce
Vladimír Bzdušek,2019-12-11 19:47:55
Síce od veci, ale, keďže sú tu znalí odborníci, otázka: Je možné aby pri horení zemného plynu v plynovom kotli došlo k produkcii CO v takom množstve, aby to otrávilo človeka? Nedôjde skôr k tomu, že plameň zhasne z nedostatku kyslíka a nadbytku CO2, ktorou kombináciou k tej prípadnej otrave dôjde? A ešte podotázka: ak počas spánku v miestnosti dochádza k plynulému zvyšovaniu koncentrácie CO2, nereaguje organizmus na situáciu zobudením?
Michal Kytka,2019-12-03 15:21:12
Mna by zaujimalo ked sa pri absolutnej nule vsetok pohyb zastavy ci prestanu fungovat a sily ktore drzia po hromade atomy a celkovo hmotu ako taku. Pretoze ak ustane akykolvek pohyb nemala by sa vytratit aj sila ako gravitacia, elektromagnetizmus a jadrove sily?
Re:
Daniel Cibulka,2019-12-03 15:47:27
Pokud bychom přišpendlili atomy na konkrétní místa, měli bychom přesnou informaci o jejich poloze (konkrétní místo v mřížce) i o hybnosti (žádná). A Heisenberg si toto nepřeje.
Re:
Pavel Hudecek,2019-12-03 15:59:30
Není mi znám důvod, proč by měly nějaké síly přestat působit.
Ale on ve skutečnosti neustane ani ten pohyb:-) Zůstanou tzv. nulové kmity, ze kterých už ale nelze čerpat klasicky termodynamicky energii, tedy objekt nejde dále klasickým způsobem chladit.
A aby to bylo zajímavější, existují i neklasické způsoby, někde tady na Oslovi je o tom článek od p. Wagnera. Ale bylo by na dlouhou diskusi, zda a za jakých předpokladů tuto "spektakulární kvantovou úchylárnu" nazývat chlazením:-)
Re: Re:
Florian Stanislav,2019-12-03 17:27:56
Souhlasím.
Absolutní nula je hypotetický stav látky, ve které se zastaví veškerý TEPELNÝ pohyb částic. Zůstanou (nulové) vibrace, pohyb je nerozlučně spjat s hmotou. Tento pohyb nelze odebrat.
https://www.aldebaran.cz/lab/planck/5_dalsi_4.php
"Ionty, atomy a molekuly konají i při absolutní nule určitý pohyb, tzv. nulové kmity. Absolutní nula tedy není stav bez pohybu, ale stav látky s nejmenším možným množstvím pohybu, které nám dovolí zákony kvantové teorie. Tento stav má teplotu –273,15 °C neboli 0 K."
Re: Re:
Jiri Naxera,2019-12-05 15:03:26
Mimochodem nasel jsem na tohle tema 60 let stary clanek https://dml.cz/handle/10338.dmlcz/138247
podle nej to jde i klasicky :)
Ale jak pisete, pisou i tam ze nejde o klasickou termodynamickou teplotu, ale teplotu ve statisticke fyzice.
(mimochodem, pletu se, nebo jak pisete ze z objektu v zakladnim stavu nelze ochlazenim klasicky cerpat energii, tak plati ze ji nelze ceprat ani nijak jinak? (nepocitam kondenzaty, pseudocastice a dalsi veselosti, kde kdyz se nepocita celkova energie systemu, tak lze delat spoustu hruznosti).
Argument by byl, ze pokud by system mohl jakkoli prejit do nizsiho energetickeho stavu, tak by do nej presel a vysledkem by bylo nestabilni vakuum, mozna existence stabilnich ccervich der atd.)
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce