Thioredoxiny (i tioredoxiny) jsou skupinou malých, ale důležitých enzymů (= reakce katalyzujících proteinů) s oxido-redukčními vlastnostmi, které regulují základní metabolické procesy téměř všech živých organismů. Jsou například klíčové pro kaskádu chemických reakcí, kterou nazýváme dýcháním jak u živočichů, tak i rostlin při fotosyntéze. V současnosti se thioredoxiny různých druhů organismů liší a tato rozmanitost je výsledkem evolučního vývoje. Klíčová role a rozšíření těchto enzymů naznačují, že doprovázely život od jeho raného stádia a ten prvotní pra-thioredoxin řídil metabolismus jednobuněčného praobyvatele Země již někdy před asi 4 miliardami let.
Kdybychom poznali přesnou strukturu enzymů, které ke svému přežití využívaly pradávné mikroorganismy, mohli bychom přes jejich vlastnosti odhalovat podmínky, v nichž se dnes již neexistující formy života vyvíjely. I když se takový úkol zdá být neřešitelný, jistá možnost přece jenom existuje. Jako všechny bílkoviny i tioredoxiny si buňka tvoří tak, že podle instrukcí zapsaných kombinací nukleotidů A, T, G a C v příslušném genu seřazuje do přesné posloupnosti aminokyseliny (viz videa pod článkem).
Bílkoviny jsou tedy řetězce různě seřazených aminokyselin. Pro každý protein je tato posloupnost jedinečná a předurčuje jaké vazby například přes vodíkové můstky se mezi jednotlivými částmi řetězce vytvoří a tedy jak se poskládá do výsledné prostorové struktury, jež je pro funkci proteinu důležitá. Míru "příbuznosti" genů se stejným nebo velmi podobným posláním u různých organismů můžeme posuzovat na základě míry podobnosti uspořádání nukleotidových párů v dvojšroubovici jejich DNA. Podobně i u homologických bílkovin porovnávání jejich posloupností ne nukleotidů, ale aminokyselin umožňuje nacházet cestu, kterou se ubíral vývoj.
Každé nahlížení do minulosti je ale ovlivněno jistou mírou nejistoty a čím hlouběji do dob dávných se chceme podívat, tím nejasnější obraz dostáváme. To ale neznamená, že se o to nemáme pokoušet, jen si musíme být vědomi i příslušného stupně nepřesnosti a nejistoty. V případě tioredoxinů se o dešifrování jejich dávných vývojových forem pokusil 13členný mezinárodní tým vědců z USA, Španělska, Japonska a Švédska. Výsledky své studie zveřejnil v dubnovém čísle časopisu Nature Structural & Molecular Biology, kde v abstraktu ve volném překladu uvádí:
Na molekulární úrovni je možné kráčet zpět v čase a rekonstruovat proteiny dávno vyhynulých organismů. Na základě fylogenetické analýzy jsme zrekonstruovali sedm tioredoxinových enzymů z prekambrického období před asi 1,4 až 4 miliardy let. Zrekonstruované enzymy v porovnání s těmi současnými jsou za vyšších teplot (až o 32 °C) stabilnější a ten nejstarší zkoumaný thioredoxin vykazuje při pH 5, tedy v mírně kyselém prostředí vyšší aktivitu než jakýkoli z dnešních typů. Výsledky speciální spektroskopie umožňující studium vlastností jediné samostatné molekuly (single-molecule force spectroscopy) naznačují, že thioredoxiny používaly stejné redukční chemické procesy, jež se zachovaly až do současnosti. V průběhu 4 miliard let se ale musely adaptovat na změny teploty a kyselosti (acidity) prostředí.
Samozřejmě, že při tomto výzkumu nejde o extrahování po miliardy let zázračně uchovaného zbytku organických součástí z nějakých fosílií, to principiálně možné není. Hledání pravděpodobné struktury dávných enzymů (nebo jiných bílkovin) vychází z dostatečně velkého souboru jejich současných forem působících v různých organismech a vede přes počítačové programy, které jednotlivé posloupnosti aminokyselin porovnají, pomohou vyhledat nejlépe evolučně zakonzervované funkční úseky, využijí statistické metody, modelování a výsledkem může být zrekonstruovaný řetězec aminokyselin některého z "předků" dnešních variant zkoumaného enzymu. Metoda se v angličtině nazývá ancestral sequence reconstruction, tedy rekonstrukce původní sekvence (spjaté s nějakým evolučním předkem).
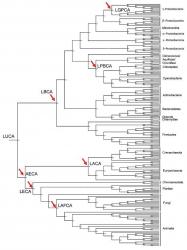
Takto postupovali vědci i při hledání dávných předchůdců dnešních thioredoxinových enzymů. Na začátku porovnali řetězce aminokyselin thioredoxinů 203 organismů, zejména různých typů bakterií, ale i hub, živočichů a rostlin, a pak pomocí zmíněné metody pátrali po struktuře, jakou tyto enzymy měly u některých dávných předků. Pro rekonstrukci in vitro, tedy ve zkumavce, si zvolili sedm pradávných thioredoxinů (na obrázku vpravo označených červenými šipkami), které řídily metabolismus například společného předka všech současných bakterií (LBCA), všech současných eukaryotů (organismů, jejichž buňky mají buněčné jádro, LECA, asi před 1,6 miliardou let), nebo předka živočichů a hub (LAFCA, 1,37 miliardy let). Reálný a ne jenom virtuální počítačem namodelovaný protein lze získat tak, že se podle jeho vypočtené sekvence aminokyselin sestaví příslušný gen, tedy taková posloupnost nukleotidů, která ho kóduje. Ta se polymerázovou řetězovou reakcí známou pod zkratkou PCR namnoží a ve formě takzvaného rekombinantního vektoru vpašuje do pokusné živé buňky, například bakterie E. coli, která podle něj začne produkovat příslušnou bílkovinu.
Vlastnosti sedmi znovuzrozených enzymů vědci prozkoumali za různých tepelných a chemických podmínek. Výsledky odpovídají představě o mladé planetě s teplejším povrchem, s prvotní atmosférou bez kyslíku a s velkým množstvím CO2 rozpuštěným ve vodách oceánů, které působily jako slabá kyselina. Proto je i maximální enzymatická aktivita nejstarších zrekonstruovaných enzymů, spjatých s raním anaerobním obdobím posunuta k nižším hodnotám pH. Zároveň u nich (u enzymů LBCA, AECA a LACA) dochází k denaturaci při vyšší teplotě - až okolo 113 °C, zatímco například thioredoxin dnešní běžné bakterie E. coli má teplotní limit 88,8 °C. I když horní hranice teplotní stability enzymů samozřejmě neznamená, že v tomto maximu pradávné mikroorganismy reálně žily, poukazuje ale na výrazně teplejší prostředí, než představuje dnešní průměrný biotop. Z analýz vědci usuzují, že teplota na Zemi v prekambriu, před 4 až 0,5 miliardami let, klesala v průměru o 5,8 °C za miliardu let.
Z laického hlediska pravděpodobně nejde o nijak převratný objev ani dech vyrážející výsledek. Přece je ale zajímavý třeba jenom tím, že minulost pozemského života dokážeme s větší či menší přesností rekapitulovat nejen pomocí zkamenělin. I geny a jimi kódované proteiny, tedy i enzymy, nabízejí jinou, molekulární cestu odhalování minulosti. Tým autorů hodlá podobným způsobem prozkoumat více enzymů v naději, že jim poskytnou přesnější obraz o tom, jaké podmínky na naší planetě panovaly na počátku života. A navíc „nové“, vlastně staré a jenom nově zrekonstruované enzymy by podle nich mohly díky svým výjimečným vlastnostem sehrát důležitou roli i v současných biotechnologiích, například při výrobě biopaliv.
Video 1: Od DNA kódu po protein populárně... a zjednodušeně.
Následující 3 videá - Syntéza bílkovin podrobněji
Zdroje: Columbia University News, Nature Structural & Molecular Biology, Supplementary Information, prezentace Juliena Dutheila/University of Arhus
Diskuze: