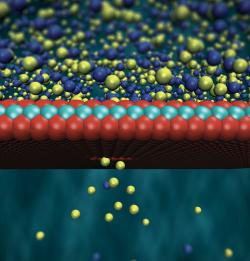
Energetika obnovitelných zdrojů dostane zajímavou posilu. Jestli se něco nepokazí, tak vedle solární, větrné nebo vodní energie dostaneme k dispozici i energii osmotickou. Jde o pozoruhodný zdroj energie, který využívá fyzikální fenomény doprovázející kontakt sladké vody se slanou.
Výzkumníci Laboratoře nanoškálové biologie Švýcarského federálního technologického institutu v Lausanne (EPFL) vyvinuli systém pro výrobu osmotické energie, který dosahuje doposud nevídaných výkonů. Vymysleli zajímavý trik, jehož podstatou je membrána o tloušťce 3 atomů. Výsledky jejich výzkumu zveřejnil na svém webu prestižní Nature.
Koncept švýcarského týmu je prostý. Když dvě kapaliny s rozdílnou koncentrací iontů solí odděluje polopropustná membrána, tak mezi kapalinami dojde k pohybu iontů, který trvá tak dlouho, dokud se koncentrace v obou kapalinách nevyrovnají. To je osmóza v kostce. Když se tohle provede se sladkou a slanou vodou, tak ionty solí proudí do sladké vody. Ionty jsou vlastně elektricky nabité atomy a jejich pohyb lze využít k získání elektrické energie.
Švýcaři k tomu použili membránu, kterou vytvořili ze sulfidu molybdeničitého (MoS2). V membráně je nanopór, kterým procházejí ionty solí ze slané vody do sladké. Když ionty procházejí nanopórem, tak jejich elektrony přejdou na elektrodu, čímž se vytvoří elektrický proud. Díky charakteru membrány procházejí kladně nabité ionty, kdežto většina z těch záporných neprojde, což podporuje vznik elektrického proudu.
Šéf výzkumu Jiandong Feng a jeho kolegové museli nalézt optimální velikost nanopóru. Kdyby byl moc velký, tak by skrz něj procházely záporně nabité ionty a výsledný elektrický proud by byl nic moc. Naopak příliš malý nanopór by způsobil, že by neprocházelo dost iontů a vytvořený elektrický proud by opět nestál za řeč. Klíčové rovněž je, aby membrána pro výrobu osmotické energie byla co nejtenčí. V těchto typech membrán platí, že čím tenčí membrána, tím více proudu. Membrána ze 3 vrstev atomů, vyrobená ze sulfidu molybdeničitého, je pro tenhle účel skvělá. Je to vůbec poprvé, co byl pro tento typ aplikace využit podobný 2D materiál. A nejspíš to nebylo naposled.
Nový systém pro výrobu osmotické energie má podle EPFL ohromný potenciál. Z jejich výpočtů vyplývá, že 1 metr čtvereční membrány se 30% povrchu pokrytými nanopóry by mohl vyrábět 1MW elektřiny, což by uživilo 50 tisíc energeticky úsporných žárovek. Klíčový materiál, tedy sulfid molybdeničitý, je snadno dostupný, vyrobit membránu není takový problém. Pokud se povede vyladit postup výroby membrány, aby na ní vznikly nanopóry stejné velikosti, tak by se mohla rozjet výroba osmotických generátorů elektřiny ve velkém.
Badatelé zatím předvedli, že jejich membrána s jediným nanopórem může pohánět nanotranzistor. V dohledné době bychom se mohli dočkat zajímavých nanoelektronických a optoelektronických aplikací, pro které bude získávat energii z okolního prostředí osmotický nanogenerátor.
Video: Water generates electricity (with a pinch of salt!)
Literatura
Nature online 13. 7. 2016.
Pitná voda z oceánu
Autor: Dagmar Gregorová (09.06.2010)
Milostná pletka grafenu s vodou
Autor: Stanislav Mihulka (16.02.2014)
Převratný grafenový filtr by mohl zajistit pitnou vodu pro celou planetu
Autor: Stanislav Mihulka (19.03.2016)
Diskuze:
Yeah. Stealth elektrony se v pravý čas demaskují na levé eldě a a opět tajůúplně mizí v pravý čas na pravé.
Josef Hrncirik,2016-07-28 07:48:10
Kdo však bez uzardění dokáže vysvětlit nevinným dětem, že LEDka je vlastně FETka a že ten cancourek mezi jejími nožičkami je životadárný EMITTOR.
Navíc podle videa nepotřebují sladkou, ale pouze ohnivou vodu.
Howgh.
Pak prostě změnou pH přešaltruji selektivitu, nebo tam dám memránu opačné selektivity a vyrobím opačnou půlperiodu střídavého proudu atd. až do úplného zblbnutí
Josef Hrncirik,2016-07-28 09:41:02
Prostě podle aktuální tržní ceny elektronů a pozitronů vypínám buď selektivitu nebo Coulombův zákon.
Josef Hrncirik,2016-07-28 10:31:31
Fundovany
Michal Lichvár,2016-07-29 09:07:40
Pan Hrncirik, vyznievate fundovano, ale co vlastne chcete povedat, nevie ani panboh. Pripadne ina vsevediaca entita.
Este Vam nik nepovedal, aby ste sa vyjadrovali k veci a jednoduchsie?
Poviem to alegoricky: knedlik sa straca v omacke.
Ve videu cca 2´02 s červené kuličky
Josef Hrncirik,2016-07-29 12:16:28
značí K+, zelené Cl-.
Proud přes membránu (tj. vlastně elektrolytem) je snad díky selektivitě při pH 11
dán pouze K+ ionty.
Ty se rozhodně nemohou hromadit v pravém prostoru (vznikal by tam naprosto šílený Coulombovský + potenciál U či gradient U(Q,C či r),
ani nemohou být redukovány nízkým napětím cca. 0,1 V, které ředění může poskytnout.
Reakce K+ + e- = K potřebuje dodat energii cca 3 V.
Navíc by to okamžitě reagovalo K + H2O = KOH + 1/2 H2.
Podobně vlevo nemůže reagovat Cl- - e- = 1/2 Cl2
Navíc by to vyžadovalo cca 1,5 V.
Proto elektroda vlevo ze které tak zázračně skáčou e- musí být Ag
Elektrony na ní vznikají reakcí Ag + Cl- = AgCl + e-
Teprve takto se dostanou do drátu.
Leč stříbro se přikrývá málo propustným AgCl a Cl- mají problém dostat se k Ag, ev. reakce probíhá pomalu, tj. zatížení A/m2 je malé, ev. to má velký odpor.
Napětí k tomu potřebné je menší než 1 V,
ale hlavně jedině ZDE pomocí 2 AgCl eld je více než kompenzováno při reakci opačné probíhající na eldě vpravo
AgCl + e- = Ag + Cl-
Jedině toto pohlcování nebo uvolňování Cl- umožní vstup/výstup e- do drátu a kompenzaci přebytečných nábojů K+ vpravo či Cl- vlevo.
Navíc celkově se pak ionty Cl- ředí se ziskem el. energie (mízí při vysoké koncentraci v levém prostoru a objevují se při nízké koncentraci vpravo). Pokud prohučí pórem (Jako že velmi často ano) energie se nezíská
Celkový efekt je pak formálně pouhé ředění soli.
Proč by se cowboyové chlubili, že k získání 1 kWh z článku cca 0,1 V (víc ze zatíženého určitě nedostanou) musí angažovat do chemické přeměny 41 kg Ag vlevo + 41 kg vpravo = cca 1 metrák aby se to nerozpadlo.
Ve videu to vtipně není (vypli coulombův zákon) a v sumární rovnici také ne, neb se to formálně vyruší a jsme zdánlivě bez problému.
V článku se pochopitelně o použití AgCl eld k MĚŘENÍ píše.
Elektrody by sice šlo po určité době přehazovat zleva doprava či přepínat proudy kapalin.
Prostě si koupí u Sigmy 100 MW argentchloridovou eldu, místo běžné 1 uW.
Odhaduji, že na 1 kW by povrch Ag či AgCl přístupný různě koncentrovaným elektrolytům musel být cca 0,5 ha.
Pochopitelně tam bude působit koncentrační polarizace a i když video či článek hledá max. P, vědomě tím kazí U, tj. selektivitu, tj. energetickou účinnost ředění na elektřinu nevratným ředěním. Při malém napětí cca 0,1 V budou ztráty z odporu ve zředěném elytu neúnosné.
Zejména po přepólování se jim elektrody budou časem rozpadat či rozpouštět.
Mohou ale vyhnat čerta Ag ďáblem Hg či satanem Cl2 elektrod vratných pro K+ či Cl-
Je nutno pokračovat dále?
Trocha chemie
Michal Lichvár,2016-07-27 11:38:48
Ak je na zaciatku v slanej casti (vlavo) K+ a Cl- a sladke casti (vpravo) len H2O, cize sem tam H3O+ a OH-, co tam bude po zbehnuti procesu?
K+ prejdu doprava do sladkej casti, Cl- odovzdaju elektron. Zostane Cl? Cize z toho bude unikat chlor v podobe Cl2?
K+ prijmu elektron? Alebo ho prijme H3O+, cize napravo nam zacne unikat vodik?
Veĺa chemie
Josef Hrncirik,2016-07-27 14:01:53
Galvanický článek se vždy skládá ze 2 kovových elektrod.
Jedna dodává elektrony do spotřebiče, druhá obvod uzavírá přijímáním elektronů protlačených spotřebičem.
Elektrody mohou být ponořeny do společného vodivého elektrolytu, nebo do 2 různých (složením či koncentrací).
Obvod musí být uzavřen i v elektrolytu proudem iontů +; -; opačnými směry (obecně různého podílu) elektrolytem.
Do 1 elektrody elektrony oxidací (název je anoda podle děje oxidace; !ale kope (-)!) jejího materiálu či redukčního činidla u jejího povrchu elektrony vchází (má jich pak přebytek a proto rozdává - náboj.
U katody naopak jsou elektrony spotřebovávány redukcí relativně oxidačního činidla.
Potenciál (redox.) elektrody závisí především na jejím složení a koncentraci vznikajících (reagujících) produktů.
Napětí článku je součet napětí elektrod a napětí rozhraní případných 2 elektrolytů.
Při ději KCl (levá) + voda jde na KCl (pravá) se nemění oxidační stavy, jen koncentrace (stále je to KCl, či lépe ale komplikovaněji K+; Cl-
Pokud by přešlo stejné množství K+ doleva a stejné Cl- doprava, změny zřeďovacích energí K+ i Cl- se vyruší a není jak získat energii. Difúzní potenciál je pak roven 0, což je notoricky známo právě pro KCl, používaný do tzv. solných můstků.
Pokud čarováním s velikostí pórů a povrchovým nábojem membrány prochází jen K+ či Cl- lze získat max. energii, jinak jen rel. podíl získaného rozdílu. Zřeďovací energie je ale malá, poskytne max. napětí cca. 0,2 V oproti chemické energii z oxidace cca 1 V.
Náboje pochopitelně vždy musí cirkulovat obvodem a nikde se nesmí hromadit.
Zřeďovací děj tedy nutně musí být doplněn dějem pohlcujícím či dodávajícím relativně neprocházející iont zde Cl- reakcí tzv. argentchloridové eldy.
Ag + Cl- +e- = AgCl či reverzně.
Pokud by tyto děje neprobíhaly na elektrodách, proud spotřebičem neprochází trvale.
Tyto děje s tuhou fází probíhají pochopitelně mnohem pomaleji než ev. difuze přes pór.
Souhrnně
(K+ +Cl-)vlevo + Ag (vlevo) = e- + AgCl (vpravo) + (K+ + H2O) vpravo = (Ag + (K+ + Cl-)*H2O )vpravo
Elektrárna tedy musí být vyfutrována bleskově reagujícím AgCl či Ag.
To ale Naturalisty určitě nebolí, protože se to v bilanci zdánlivě neprojevuje.
Publish or perish.
Aby tam byl malý odpor, muselo by být vše s minimální tloušťkou.
Zřeďování difúzí bez míchání je pomalé. Vyžadované průtoky vyvolají velké tlakové rozdíly žeroucí energii a trhající 1 atomovou membránu.
Kéž by to nebyla ukázka reálné digitální debilizace, ale jen nedbalosti.
Re: Veĺa chemie
Michal Lichvár,2016-07-27 16:04:02
leva / prava: ja vychadzam z videa na konci. Vlavo na zaciatku KCl, napravo je na zaciatku voda sladka, mozme si asi predstavit destilku.
Ja to chapem tak, ze cez membranu prejdu len K+, nic ine, ziadne Cl-, Ag ani pod.
Preco by tam musel byt reverzny Cl? Nerovnovaha v naboji, ktora vznikne prechodom K+ doprava (do sladkej vody), sa vyrovna odovzdanim - z Cl na elektrode vlavo. Ci tak to nemoze fungovat?
Alebo je to tak, ze Cl zostane minus ale odovzda sa OH- a uvolnuje sa kyslik? Taka elektrolyza naopak?
Málo maturit
Josef Hrncirik,2016-07-27 17:17:11
Membrána skutečně dělí chvilinku ionty, ale pokud ty nejsou trvale odstraňovány, vznikne jejich působením protipotenciál a děj se zastaví.
Je napětí, ale není proud.
Aby membrána trvale jako Popelka rozdělila náboje či teplé a studené molekuly, potřebuje dodat energii či informaci, nebo je to perpetum mobile I. či II. druhu.
K+ ionty do drátů zatím veřejně nelezou.
Proto tam musí být
" K+ + e- z drátu vpravo + na drátu vpravo povlak AgCl = dá Ag na drátě zlomyslně překrývající AgCl + KCl + voda hojně dodávaná na pravou stranu ".
Hybnou silou děje je ředění soli, které je komplikovaně spřaženo s větší selektivitou pro 1 z iontů a redukcí AgCl umožňující zapřaženými elektrony proudit dráty.
Hybná síla ze zředění sama slabá a statistické entropické povahy, se navíc formálně zeslabuje velkou drahou tj. malým koncentračním gradientem, oproti silnému poli v krátké vznikající vazbě např. při K + 1/2 Cl2 = KCl.
Alespoň číňan by mohl vědět, že v moři je NaCl, nikoliv jimi použité KCl.
Jakýkoliv alternativní vznik Cl2 či H2 či K vyžaduje energie řádově větší než dostupné zřeďovací a naprosto zde nenastává.
Video je roztomilé. Náboje se rozdělily a co vlastně leze do drátů?
Prostě láska zvítězila nad galvanickými a koncentračními články (v době teroru učivem FCH II. na SPŠCH či VŠCHT).
Až na to 2x přehnané napětí (proud či odpor či výkon na 1 nanopóru, četl jsem jen doplňky zdarma)je to v zásadě dobře.
Trhy si ale žádají elektrárny a tak je mají.
Hrůznost videa asi odbornému dohledu nebo dokonce autorům článku nedochází.
Kde udělali soudruzi z NDR chybu?
Přišlo rozvolněné studium
Josef Hrncirik,2016-07-25 09:34:38
Zakoupené mozky pomocí simulací a snad i experimentálně zjistily, že při pH 11 se chudák 1 vrstvá MoS2 membrána chová v okolí hrany otvoru do jisté míry jako nepropustná pro Cl- ionty a transport probíhá v okolí hrany K+ ionty.
Vytvořili tedy koncentrační článek s relativně selektivním převodem K+ ionty.
Nešťastné K+ , které převodem zpočátku tvoří měřitelný proud však nemohou být absorbovány ani uvolňovány použitými AgCl elektrodami (což je nutné pro trvalý odběr proudu) a po určité době vytvoří protipotenciál a blackout.
Ionty Cl-, které naopak AgCl elektrody mohou vratně vyměňovat, však membrána dokonce schválně při pH 11 nemá propouštět. Je to prostě jednorázovka počátku nabíjení či vybíjení dvouvrstvy iontů.
Kdyby použili jiný elektrolyt než KCl, které má nulový difúzní potenciál (jak známo ze základních kurzů elektrochemie), nemuseli by laborovat s pH 11 a jen s AgCl elektrodami by měli elektrárnu i s makropóry.
Kdyby použili materiály vratné draslíkové elektrody na bázi zakázaného amalgamu, mohli zabránit blackoutu při svých pH 11.
Póry mohli mít makro i bez pH 11, stačilo použít materiály pro selektivní draslíkové elektrody.
Stále to ale je snaha udělat v záadě elektrárnu z pH elektrody, či nejlépe z pH FET eldy.
Možná, že v nějaké záhadné geometrii pro 1 pór d = 7 nm naměřili výkon 18 nW při odporu 9,4 Mohm, tj. při cca 0,4 V. Z toho jim pochopitelně vyšlo cca 10 MW/m2 díry.
Z toho by také vyšlo, že m2 elektrárny má paralelně odpor cca 5*10**-11 ohm.
Únik do FET tranzistoru určitě dokonale zmátl domorodce, kteří je platí.
Z tohoto hlediska článek nemá chybu.
Ďáblové se skrývají nejen v detailech. Děsně řvou již z termodynamiky procesu.
Josef Hrncirik,2016-07-26 09:09:30
Z maximálně měřeného ředění 1000/1 mohli dostat nanejvýš napětí 0,18 V.
V grafech mají uvěřitelných cca 0,1V.
Tvrdí však, že nanopór dal 0,4 V (nezkontrolovali si, že to plyne z jejich údajů výkonu a odporu.
Tvrdí, že mají 1 MW/m2, tj. 100 W/cm2.
Při ještě uvěřitelných 0,18 V by proud I = 556 A , tj. R = 0,32 mOhm.
Pokud lze drein AgCl elektrody zatěžovat cca. 0,1 mA/cm2 , pak potřebují jen 2* 556 m2 AgCl eldy/cm2 elektrárny a na koncentrované straně stačí průtok 6 ml/s 1 M KCl, leč na zředěné straně už to musí být 6 l/s.
Při vodivosti zředěné strany 0,12 mS/cm, požadovaný odpor 0,32 mOhm vyžaduje tloušťku zředěné vrstvy jen 380 nm.
Tudíž tam voda musí proudit rychlostí alespoň 1600 km/s.
Nebo to bude 556 m2 místo 1 cm2.
Howgh.
Nanoflowcell
kirtaP akruK,2016-07-24 19:19:08
Vím, že článek už je "starší", ale němela podobně fungovat technologie "nanoflowcell", která měla být v autě?
1MW/m3
Alexandr Kostka,2016-07-18 12:45:23
Teorie je krásná, ale v praxi to bude mnohem méně. Na druhou stranu, i kdyby to bylo "jen" 100W/1m2, tak by šlo o geniální zdroj elektřiny. Tak nějak mi vychází, že 1 km2 by dal 100 MW. A kilometr čtvereční tenkých membrán by se dal nacpat do relativně malé stavby v ústí snad jakékoliv řeky.
Kilometr ctverecni membran
Josef Blecha,2016-07-18 22:14:07
by se nepochybne do relativne male stavby do usti reky nacpat dal. Po spusteni by se vam behem hodiny ucpaly vsechny pory v membranach. Alternativne byste musel vsechnu energii ziskanou smisenim nacpat do cisteni te sladke i slane vody. Pak by se vam membrany ucpaly o neco pozdeji, treba az za dva dny nebo tak. Ovsem genialni by to rozhodne bylo.
Jenom trochu termodynamiky na okraj,
Josef Blecha,2016-07-16 15:14:41
energie získaná smíšením 1 m3 slané a sladké vody nemůže být vyšší než výparné teplo 1 m3 vody, jinak by bylo možné zrealizovat perpetuum mobile. V publikaci měřili 1 pór a ponásobili to prostě předpokládaným počtem pórů na 1 m2 membrány. O nějaké realizaci tam samozřejmě není ani slovo, takže úvahy jak a kam odvádět proud a teplo jsou velmi předčasné.
A tedy procezením 1 kg vody
Josef Blecha,2016-07-16 17:37:16
obsahujícího max. 359 g soli přes membránu můžu získat max. 0.628 kWh energie, tedy v ideálním případě. Asi to bude i chvíli trvat, takže se nám už ta závratná výkonová čísla redukují.
Re: A tedy procezením 1 kg vody
Richard Palkovac,2016-07-17 07:56:03
To maximalne mnozstvo energie ziskatelne zo soli mate z nejakeho doveryhodneho zdroja ? Zaujima ma to len preto, lebo sa to celkom blizi mojmu laickemu vypoctu, co by ma tesilo.
Re: Re: A tedy procezením 1 kg vody
Richard Palkovac,2016-07-17 08:22:05
Aha, Vy mate na mysli vyparne teplo kg vody, tak nic.
fotosyntéza
Mojmir Kosco,2016-07-16 12:38:38
Má účinnost cca 30% celkem a je trvalé obnovitelný zdroj. V jednotlivostech třeba pří výměně v rámci osmozy 99% .Energie vyprodukuje gigawatty .To napadání v článku popsaného fyzikálního principu diskutéry bude správné .Ale kdyby se dostali ke stejné hodnotě v makro velikosti jako fotosyntéza pořád to je zajímavé .
Re: fotosyntéza nemá zdaleka účinnost
Josef Blecha,2016-07-16 15:18:49
30 procent, je to zhruba 1%, jó, kdybysme měli těch procent 30, to by se nám žilo. Pod účinností je myšlena konverze dopadajícího PAR záření do nějaké energetické sloučeniny, jako jsou cukry ap. I to 1% je dost hodně.
Re: Re: fotosyntéza nemá zdaleka účinnost
Mojmir Kosco,2016-07-16 17:43:57
Na syntézu jednoho molu glukózy je potřeba 6 × 8 = 48 molů fotonů, což odpovídá energii
8440,6 kJ/mol. Z glukózy se ale uvolní pouze 2884,5 kJ/mol, účinnost fotosyntézy je tedy 34,2 % (2884,4 × 100 % :
8440,6). Jedná se o konečný produkt
Když ono je to těžké, vysvětlit něco lidem,
Josef Blecha,2016-07-16 19:36:28
kteří ovládají pouze aritmetiku, ale nerozumí tématu. Přístupně a jednoduše je vše vysvětleno třeba v David Alan Walker: Biofuels, facts, fantasy, and feasibility, J Appl Phycol (2009) 21:509–517, DOI 10.1007/s10811-009-9446-5:
A photon mole of red light, with a wavelength of about
680 nm, has an energy content (Walker 2000) of about
42 kcal (176 kJ). Burn one gram molecule of C6H12O6 in a
calorimeter and 672 kcal is released as heat. The formation
of one ‘CH2O’ therefore requires an input of at least 672/
6=112 kcal (468 kJ) and, when this is supplied by eight
photons of red light, the arithmetic becomes 112/(8×42)×
100=33%. However, rather less than 50% of sunlight is
photosynthetically active radiation (PAR). The energy
content of an average photon mole of visible light in this
range is about 50 kcal (209 kJ) and, using the leaf-disk
electrode (Delieu and Walker 1981), the mean quantum
requirement for thirty seven C3 species was found to be
9.4 (Bjorkman and Demmig 1987). This has been
repeatedly confirmed (see, e.g., Walker 1987, Walker
1989, Walker and Osmond 1986, Seaton and Walker 1990). So, introducing these values, we can arrive at 112/(9.4×50 )×0.5×100=11.9%.
It cannot be too strongly emphasized that 11.9% (cf.
Radmer and Kok 1977) is an unequivocal theoretical
maximum that will never be realized by a growing crop
of whatever nature even when all adverse factors such as
disease, predation, inadequate inorganic nutrients and suboptimal
water are disregarded. This is because the actual
quantum yield (i.e., the reciprocal of the quantum requirement)
invariably decreases as the photon flux density
approaches light saturation (at about one fifth of full
sunlight for C3 species) and the fact that environmental
factors such as temperature (Spalding et al. 1980) vary
during daylight hours and are rarely optimal.
Atd. atd., a nakonec vám vyjde, že praktická fotosyntéza, ať už na poli nebo u řas, vám poskytne v biomase asi tak 1% dopadající světelné energie.
Kde ste chemici ???
Richard Palkovac,2016-07-16 10:43:23
Hmmm asi tu nie je ziadny chemik, co by nam pomohol, alebo aj je, ale je tajnostkar ? Ja som do chemie uplne tupy, tak, ale nieco skusim spocitat.
Kupim kilo soli v Tescu a ked sa mi podari kazdu molekulu toho kila uplne rozlozit, kolko dostanem energie ?
1 kg soli by malo byt 17,1 mol, teda 17,1 x 6E+23 = 1,026E+025 molekul.
Predpokladam, ze 1 molekula ma vazobnu energiu 5 eV.
1eV = 1,6E-19 Ws (watt sekund)
Takze z kila soli mam 1,026E+025*5*1,6E-19 = 8208000 Ws
Ws premenime na Wh 8208000/3600 = 2280 Wh co su priblizne 2,2 kWh.
A to som ratal velmi optimisticky, kilo soli ma bude stat viac ako 2 kWh elektriky, rusim svoj inzerat.
Re: Kde ste chemici ???
Drahomír Strouhal,2016-07-18 13:03:15
Za deset kaček 2kWh elektřiny? To je slušná cena v případě, že nutně potřebujete baterii a není kde koupit monočlánky.
Re: Re: Kde ste chemici ???
Richard Palkovac,2016-07-18 15:30:40
A co s tym bordelom, co z tej vyroby elektriky vznikne ? Sup s tym do potoka ?
Re: Re: Re: Kde ste chemici ???
Drahomír Strouhal,2016-07-22 14:24:58
Jaký bordel? Výsledkem naředěná slaná voda. Když ji necháte vypařit, tak můžete proces zopakovat :-)
Re: Re: Re: Re: Kde ste chemici ???
Richard Palkovac,2016-07-22 15:06:43
Ako pisem, som do chemie blby, ale myslim, ze tam vznikne bud kyselina chlorovodikova, alebo hydroxid sodny a to su dost neprijemne zieraviny.
Inzerovaný výkon
Lukáš Kment,2016-07-15 16:01:39
Ono pokud se podíváte na ty grafy uvedené pod tím článkem, tak zjistíte, že je tam generováno napětí řádově maximálně ve stovkách miliVoltů a proud řádově v desítkách nanoAmpér. Z toho si lze snadno udělat představu o výsledném výkonu, které rozhodně nebude v mega, kilo ... on nebude ani ve wattech :) Osobně si myslím, že tam skutečně má být 10 na mínus 6 wattu.
Re: Inzerovaný výkon
Luděk Horáček,2016-07-15 16:23:42
http://www.nature.com/nature/journal/vaop/ncurrent/carousel/nature18593-st1.jpg
V této tabulce je jasně, 10^6 W/m^2.
Že jsou v grafech:
http://www.nature.com/nature/journal/vaop/ncurrent/carousel/nature18593-f2.jpg
čísla s exponentem 10^-9 bude asi tím, že grafy jsou o jedné jediné nanopóře.
Re: Re: Inzerovaný výkon
Richard Palkovac,2016-07-15 18:15:56
Otazke je, ze co sa zmeni po vyrobeni tej energie ? Urcite nejde o jadrovu energiu, takze jadro vynechajme. Zostane nam energia chemickych vazieb. S kade budu tie MW ? Zmeni sa ta sol ? Zmeni sa ta membrana ? Zmeni sa voda ?
Este je tu taka moznost, ze ten MW (co je vykon, nie energia) je vlastne velmi mala energia, lebo by to cele fungovalo len povedzme sekundu .
Inzerat.
Richard Palkovac,2016-07-15 13:50:30
Kupim 10 cm stvorcovych membrány pre výrobu osmotickej energie s vykonovym parametrom 1MW/mxm (nepotrebujem MW staci mi 10 kW).
(sol kupim v Tescu a vodu mam v potoku)
Cena dohodou.
Re: Inzerat.
Richard Palkovac,2016-07-15 14:52:58
Ouups mal som na mysli 100 cm stvorcovych , 10cmx10cm.
Divné
Josef Šoltes,2016-07-15 13:38:44
Mne se to nějak nezdá. Ale 1 MW výkonu na m čtvereční, to už je pořádná dávka energie. Kudy to ta membrána odvede? Vždyť by to musel být ultrasupravodič, jestli je tenká na tři atomy! Celé je to nějaké divné.
Re: Divné
Josef Šoltes,2016-07-15 14:42:31
Navíc předpokládám zákon zachování energie. I kdyby měla reakce 100% účinnost a veškerá energie se měnila na elektrickou, tak mi přijde, že k výkonu 1 MW by muselo docházet k průchodu obřího množství iontů, to nebude jen tak nějaké kilíčko.
Re: Divné
Josef Šoltes,2016-07-15 14:49:31
A ještě mi nejde do hlavy, kde se tam ta energie bere. Neutralizace (opak hydrolýzy) v našem příkladu použité HCl a NaOH je mám dojem exotermická, tedy uvolňuje teplo. Opak (lýza) je tedy endotermický a teplo a energii naopak vyžaduje. I kdybychom připustili možnost prostupu iontů Na+, tak Cl- by okamžitě na druhé straně zreagovalo s vodou za vzniku kyseliny chlorovodíkové. Nic moc matroš. A Na+ by předpokládám muselo odněkud vzít elektron, aby došlo ke vzniku proudu... Prostě nějak nechápu, jak to má fungovat. Co je tu katoda a co anoda?
Výkon 1 MW/m2 ?
Juraj Chovan,2016-07-15 10:52:48
V článku uvedený výkon 1 MW na 1m2 znamená že plachta 20x20 m2 vygeneruje výkon 400MW, čo je porovnateľné s výkonom 1 jadrového reaktora JE Jaslovské Bohunice.
Až sa nechce veriť že si autor nepomýlil MW s kW...
Re: Re: Výkon 1 MW/m2 ?
Pavel Riedl,2016-07-15 11:42:30
Kvůlivá tomu jsem se schválně díval na zdroj a je tam uvedeno: "...estimated power density of up to 10^6 watts per square metre...", ale taky mi to přijde nějak moc.
Zdroj:
http://www.nature.com/nature/journal/vaop/ncurrent/full/nature18593.html
Chybička se vloudí; šotek umazal - , ale všichni už mají ´ a jsou za vodou. Publish nebo si vylish.
Josef Hrncirik,2016-07-15 12:13:30
Re: Re: Re: Výkon 1 MW/m2 ?
Jiří Svejkovský,2016-07-15 12:18:36
Pak bych ještě očekával problémy se značnou proudovou hustotou u tak tenké membrány.
Re: Re: Re: Re: Výkon 1 MW/m2 ?
Josef Hrncirik,2016-07-15 14:52:21
Bude to navíc jako neúsporná žárovka (tzv. světelná koule) osvětlovat PV panel.
Při velmi silné kladné zpětné vazbě dochází k explozi
Synchronizovaným postřikem hlavní plachty 2 vodami Darpa uskutečnila n úspěšných výstřelů z reilgun.
Josef Hrncirik,2016-07-15 12:16:39
Re: Výkon 1 MW/m2 ?
Marek Fucila,2016-07-15 12:33:02
Ako rýchlo také riedenie prebieha? Predstavme si auto s nádržou o ploche 1 m2, výška povedzme 10cm. 5cm slanej vody a nad(alebo pod?) ňou 5 cm sladkej. Hmotnosť zhruba metrák, to by mohlo byť aj na streche. Ak sa to zmieša za pár minút bola by to slušná nabíjačka pre elektromobil.
Ak by to prebiehalo hodinu, možno by ani baterky neboli potrebné a 1MW (1341 koní) by už za 100 litrov vody a možno kilo soli a máme super auto. :-) http://www.gizmag.com/koenigsegg-one1-megacar/31038/
Zřeďovací energie se uvolňuje na úkor zřeďovací entropie
Josef Hrncirik,2016-07-15 14:59:23
Při směšování 1 m3 mořské vody s 1 m3 sladké při 25°C lze získat max. 6 kJ energie
(a 20% bodů zápočtové písemky).
No passaram.
Reparát = (n1+n2)*R*T*ln(c1/c2)
Josef Hrncirik,2016-07-29 12:53:13
Tj. 1,72 MJ pro 1m3 3% soli (voda moří) + 1 m3 dešťovky tj. 3,4 kj/mol soli=cca 60 g/mol.
Pakliže jak navrhují ředím až 1/1000 dostanu sice až 17 MJ/1001 m3 vod, tj. 17 kJ/m3 vod,
tj. 17 J/kg vod tj. mohu si dovolit pouze manipulační ztrátu výšky vod při 50% účinnosti pouze 0,85 m.
Bez přílivu to nedostanou ani do potrubí.
Krmte vodárnu metrovým rozdílem hladin a vyrábějte navíc 1 MW/m2
Re: Výkon 1 MW/m2 ?
Vít Výmola,2016-07-15 13:04:10
Ten udávaný výkone je opravdu těžko k uvěření. Určitě je v tom schovaný nějaký háček (nebo spíš hák), který asi nedokážeme z článku posoudit.
Protože, kdyby to tak skutečně mělo bez háčků fungovat, můžeme přestat vymýšlet fúzní reaktory a vlastně klasické elektrárny vůbec.
Zbývá jenom vyřešit nanočištění zanesených membrán.
Josef Hrncirik,2016-07-15 06:34:52
Aby na membráně při rozumném průtoku vznikla ještě přijatelná ztráta tlaku, musí mít plochu několik akrů.
Kdo bude vykupovat nebezpečné odpady z nánočištění a nánodialýzy?
Jinak to nemá chybu.
A to jsem četl jenom nadpis.
Jak vidno zříti, trhlinou v membráně prochází pouze malé elektrony, mezi kterými se těch několik pozitronů zcela ztrácí.
Josef Hrncirik,2016-07-15 07:34:59
Proud elektronů je pak dle libosti zesilován komerčními IO zesilovači a veden na svorky PV panelů na každé běžné střeše, prochází střídačem a pohání větrník.
Re: Jak vidno zříti, trhlinou v membráně prochází pouze malé elektrony, mezi kterými se těch několik pozitronů zcela ztrácí.
Josef Hrncirik,2016-07-15 07:38:25
Proč je pod tou helvétskou vlajkou tolik číňanů?
Osmotická kontrarevoluce
Josef Hrncirik,2016-07-15 10:33:54
Ion projde a na membráně se vytvoří tzv. membránový potenciál bránící průchodu dalších iontů, tj. možnosti odebírat proud a konat práci.
Je to jednorázový generátor slaboproudý a potom bezproudový.
Je jako když někomu upadne nenabitý superkapacitor do móře a neuloví se žádný úhoř, natož tuňák.
NANOMEMBRÁNY
Vlastislav Výprachtický,2016-07-15 05:45:33
Různé nanomembrány - různé prostupy iontů. Využití osmotických pochodů bude spíše využito v mikroelektronice a ve zdravotnictví. Jako průmyslové využití pro zdroj elektřiny by to vyžadovalo vedlejší náročné přípravné procesy k zajištění kvality vody.
Jsem asi šťoura
Marcel Brokát,2016-07-15 03:52:08
ale nebyla by to energetická revoluce? Energetická lobby spí?
Taky bych to chtěl podrobněji
Jiří Pospíšil,2016-07-15 00:22:56
No počkáme, třeba o tom, bude-li pokrok a víc než jeden nanopór, ještě uslyšíme a bude to vysvětleno podrobněji.
Mě pak napadá technický problém, kde vezmou tak čistou vodu, aby se jim ty póry, jejichž velikost je klíčová, zachovaly nezanesené?
Problém světa je spíš opačný, získávání sladké vody ze slané, vyrábění slané vody ze sladké mi nepříjde moc účelné. Ale počkáme a uvidíme. Třeba jednou budou články na tramp, ke kterým se bude nosit pytlík soli. Člověk si dobije mobil, bez kterého už většina lidí nejde prostě nikam, u studánky.
Re: Sladká voda
Aleš Procháska,2016-07-14 23:22:32
Pochopil jsem článek tak, že místo toho aby se sladká voda jen tak míchala se slanou v ústí řeky do moře, tak se bude míchat v osmotickém generátoru.
Ano, takto by bylo možno získat onu zanedbatelnou zřeďovací tj. směšovací či cca osmotickou energii.
Josef Hrncirik,2016-07-15 11:41:22
O TOM JIŽ BYL DÁVNO V OSLU ČLÁNEK.
Jak vidno, špičky z EPFL a Nature zatím OSLA nečtou, protože je bez poplatků.
To co navrhují, je jen čerpání energie ze zředění prvními ionty při tvorbě membránového potenciálu. Pak je už jen BLACKOUT z nedostatku tradičního evropského vzdělávání.
Mohl by to zkusit někdo trochu víc vysvětlit?
Karel S.,2016-07-14 20:35:12
Pokud jsem to správně pochopil, tak mají membránu, která propouští ionty, kladné a na její druhé straně zůstávají záporné. No ale pokud chlorid sodný ve vodě, nepletu-li se, disociuje na Na+ Cl-, pak, pokud procházejí jen kladné ionty, to znamená že na jedné straně vzniká elementární sodík, který okamžitě reaguje na NaOH za uvolnění vodíku a na druhé by se měl uvolňovat chlor. To mi nějak nesedí. Kde je chyba? Co přehlížím? Sedí vůbec po chemické stránce ZZE dle vazebných energií?
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce