Většina současných baterií, jako jsou například všudypřítomné dobíjitelné lithium-iontové baterie, je vyrobena z kovů. Ty kovy je nutné vytěžit a zpracovat, což obvykle značně zatěžuje životní prostředí. A s kovovými bateriemi je problém i po jejich využití. Představují odpad, s nímž není úplně jednoduché pořízení. Odborníci proto pracují na nových typech baterií, které by ve svých parametrech předčily ty stávající.
Christian Strietzel ze švédské Uppsala Universitet a jeho spolupracovníci vyvinuli nový typ experimentální protonové baterie, která je postavená z organických komponent. Díky tomu je mnohem vstřícnější vůči životnímu prostředí. Za zmínku jistě stojí i to, že tuhle baterii je možné dobít během pár minut, a také to, že funguje za velmi nízkých teplot.
Nová baterie je založená na chinonech, organických sloučeninách, které se často podílejí na energetických pochodech v živých organismech, jako je fotosyntéza nebo buněčné dýchání. Ve zmíněné baterii jsou elektrody vytvořené z pevných polymerů chinonů. Elektrody obklopuje kyselý roztok v roli elektrolytu. Baterie funguje podobně jak lithium-iontová baterie, jen se v ní pohybují vodíkové ionty, čili protony. Vzhledem k tomu se mluví o „protonové baterii“.
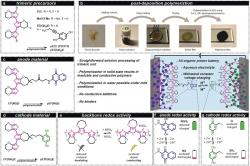
Prozatím jde o baterii, s pouhými 60 mAh/g. Výhodou organické protonové baterie je její nízká toxicita a organická povaha, která se pojí s dobitím plné kapacity za 100 sekund. Dosavadní testy ukazují, že baterie vydrží 500 cyklů vybití a opětovného dobití, aniž by došlo k citelnému poklesu její kapacity. Díky použitému elektrolytu je baterie bezpečnější než obvykle a nemůže explodovat nebo vzplanout.
Jak upozorňuje Strietzel, výkon dnešních baterií obvykle nápadně klesá za nízkých teplot. Se svým týmem si ověřil, že organická protonová baterie si udrží kapacitu i další charakteristiky, i když teplota klesne na mínus 24 °C. Design baterie podle všeho funguje. Teď ještě bude nutné vyladit klíčové parametry baterie. Možná dojde i na výměnu použitých chinonů. Do praktického využití organické protonové baterie je nejspíš ještě daleko, ale nejspíš o jich ještě uslyšíme.
Literatura
Nadupané biobaterie na cukr
Autor: Stanislav Mihulka (01.02.2014)
Továrna na baterie Horní Suchá
Autor: Vladimír Wagner (15.09.2018)
Nová lithiová baterie pohlcuje oxid uhličitý a vyrábí karbonát
Autor: Stanislav Mihulka (01.10.2018)
Maličké biobaterie budou pohánět Internet věcí na jedno použití
Autor: Stanislav Mihulka (16.06.2019)
Nová geotermální baterie přeměňuje teplo přímo na elektřinu
Autor: Stanislav Mihulka (25.07.2019)
Kvantová nanobaterie by neměla ztrácet uložený elektrický náboj
Autor: Stanislav Mihulka (26.10.2019)
Nová zahřívací Li-Ion baterie se nabije pro jízdu elektromobilu za 10 minut
Autor: Stanislav Mihulka (05.11.2019)
Diskuze:
Čerstvě hydratovaný proton = dobrý sluha, ale zlý Pán!
Josef Hrncirik,2020-04-29 09:29:09
Za onoho nevýslovného času, jistý nejmenovaný docent fyzikální chemie překonal slepou tržní sílu a podpultově si pořídil bulharské Pb aku.
Vědecky vypočetl potřebné množství konc. H2SO4 p.a. a zapůjčenou kyselinu v potřebném množství do aku láskyplně nalil. Stejně naložil i s aqua destilata, kterou se mu kupodivu podařilo do aku bez problému majetkově kvantitativně převést.
Když z milovaného aku začala syčet pára a tavit se zálivka z albánského asfaltu u elektrodových vývodů, zeptal se mě, zda nedošlo ke zkratu nabytého aku snadno nabytým vařícím vodivým elektrolytem. Usnesli jsme se vychladit zdivočelé aku vodou s ledem v kýblu na šampus a pro jistotu ho dobít erárním proudem z erární nabíječky.
Takto dobře zahořené aku startovalo bez problémů cca 10 let až do sulfatace.
Do oživovacích mystérií desulfatace jsem již nebyl zasvěcen.
Důležitá je jen cena
P Sax,2020-04-13 20:43:14
A to jak za kWh instalovanou, tak za kWh/životnost.
Instalační stačí pod 10Kč/kWh a máme vyhráno.
9 stran článku
Josef Hrncirik,2020-04-13 20:37:05
Baterie je barnumsky nazvána jako protonová, přestože by spíše měla být nazvána naftochinon - benzochinon – hydrochinony; 5% H2SO4 baterie. Chinony jsou poměrně slabá oxidovadla, slabší než v bateriích používaná anorganická či kyslík. Hydrochinony jsou slabší redukovadla než vodík a více než 3x slabší než vyredukované lithium i částečně oxidované interkalací. Baterie či superkapacitory s vodným elektrolytem nemohou dodat více než cca 2,3 V protože vodný elektrolyt se již spontánně začíná elektrolyzovat. Kyslíko-vodíkový článek se svými 1,23 V není zvláštní výhra, ale zachraňují to poněkud alespoň 2 e-/H2 tj. 2F náboje/2g H2; relativně dobrá aktivace H2 Pt kovy a ev. možnost čerpat potřebný O2 z/či do atmosféry. O2 elda se aktivuje mnohem obtížněji než H2 a má větší ztráty z nutného přepětí. Kvůli velmi nízkému využitelnému napětí a rozpustnosti v elektrolytech, kterou by mísením oxidovadla a redukovadla difúzí přes separátor nutně docházelo k chemickému zkratu, zřejmě nikdo nezkonstruoval prakticky využitelný článek ne jejich bázi, přestože chinhydhonová elda je notoricky známa generacím chemiků. Kombinace nafto-benzochinon poskytne napětí možná i jen 0,2 V. Teprve použití N-substituovaného naftochinonu umožnilo kombinaci s benzochinonem získat napětí cca 0,35 – snad 0,4 V. U těchto látek je nutno snížit rozpustnost, tj. spojit je do polymeru, pokud možno vodivého. Byly syntetizovány vhodné chinonové deriváty terthiofenu, které lze mírnou oxidací poněkud pospojovat (polymerace je asi přehnané přání) a přitom se tvorbou chinoidní struktury oxidací thiofenů dosáhne přijatelné vodivosti. Kameny úrazu jsou v tom, že při nabíjení naftochinonu přebitím se může snadno chinoidní polythiofen zredukovat na nevodivý a nevodivost způsobí i příliš silná oxidace řetězce či síry u benzochinonové eldy. V kombinaci s thiofenovým vodivým polymerem asi nelze získat více než 0,6 V místo zde opěvaných 0,35. Redox reakce chinon Q – hydrochinon H se sice účastní H3O+ ionty ; Q + 2 e- + 2 H3O+ = H + H2O; ale obvykle to nedramatizují ni atomoví fyzici, kteří často žertovně píší Q+2e-+2H+=H; rozhodně jsem neviděl zápis Q +2p+2e=H; zápis Q+2H=H je taky správně; pro zmatení nepřátel se doporučuje použít Q+H2O+2e= 2OH-. Coin baterii lze dobít během několika minut, protože má zanedbatelnou kapacitu 216 m.A.s . Tím v podstatě končí celá krásná pohádka. Je postavena z organických komponent, jsou v ní celkem cca 2 mg polymerních chinonů. Aby měla udávaných 60 mAh/g, musela by obsahovat cca 2,1 g polymerních Q; píší že NQ je o 10% slabší než BQ (kapacitně) a že NQ není schopen pokryvu více než 10 mg/cm2. I kdyby v minci měly eldy průměr 1,4 cm a nános z obou stran karbonového kotouče eldy bylo by tam 57 mg NQ polymeru a kapacita mince by byla 1,7 mAh při 0,35V. Na 60 mAh tedy musíme vydat cca 35 mincí. Knoflík Li 2032 dá při 2,9 V 190 mAh a průměru 2 cm. Nabíjecí Lion ML2032 dá jen 65 mAh při 3V. Nabíjecí Lion LiR2450 dá 120 mAh při 3V. Náhradou za LiR2450 bychom na stejnou energii potřebovali 605 poctivých organických mincí . Mincí z obr 1 by stačilo 31400 ks. Nelžou, ani to není klamavá reklama. Je nutno číst mezi řádky. I to rocking chair proton battery v abstraktu je správně. Trochu Vás pohoupali jak slíbili. Každý přece vidí, že při max. 10 mg/cm2 tam nemůže být gram aktivní elektrodové hmoty. Je to normální Darwinův výběr baterií zákazníkem. Pochopitelně se mu nechce číst 9 s článku a 52 s suplementů a proto(n) bude po zásluze potrestán, že si dával pohov v chemii. Navíc i ta protonodárná H2SO4 pak vypadá eko. Logicky. Pochopitelně že v Pb aku je H2SO4 30%, protože má největší vodivost (i protonovou) a mrzne až pod -27°C. Pochopitelně i v Pb aku může být sírovka imobilizovaná jako gel. Byli by blbí, kdyby se v abstraktu chlubili rekordně bezpečným napětím protonové baterie 0,35 V.
ALLAH ale vidí, že 0,35 V hrdinně přiznali 10 cm před koncem článku. Přidali si jen křesťanských 14 % DPH a napětí bez dlouhého smlouvání ustálili na rekordních 0,4 V.
Těším se na 52 s příloh!
Re: 52 stran organických příloh v 5 % kyselině sírové
Josef Hrncirik,2020-04-14 15:02:00
Na s. S2 jasně píší, že nánosy vodivých el. hmot vždy 2 mg/cm2 byly prováděny na destičky skelného uhlíku tlusté min 0,5 mm. V prototypovém článku elda měla cca 0,5 cm2, tj. bylo na ní 1 mg polym. chinonu. Elektrochemie jednotlivých elektrod byla sledována měřením redox proudů při pomalých nárůstech či poklesech napětí na potenciostatu. Vodivost byla měřena u povlaku na Au hřebeni nikoliv chybně 10 mm between bands, ale jen 10 um. Stejně nebyla z grafu skenem 10 mV/s vyčíslena. Na S2 tvrdí, že KBr tablety pro IR analýzu lisovali tlakem pouhých 8 bar. Určitě však museli lisovat 8 kbar. Připravované meziprodukty syntézy modifikovaných thiofenů kontrolovali H NMR 400 MHz i C13 NMR 100 MHz a na hmotovém spektrografu. Připravili a specifikovali cca 20 látek v souvislosti s přípravou funkční vodivé katodové a anodové hmoty. Polymerace thiofenů je sledována z průběhu vodivosti a proudu během vzrůstem napětí způsobené jejich oxidace. Materiálové hodnoty měrné vodivosti však nejsou z grafů ani odhadnuty. Je zřejmé, že poměrně slabá redukce již při 0 V vůči H2 eldě (SHE) vede k výraznému poklesu vodivosti. Na obr. S23 pro zmatení laskavého čtenáře uvádí potenciál vůči tajemnému potenciálu ferocenové eldy. Z S24 by mohl vzniknout dojem, že redox reakce překlenuje měřené rozpětí až 1 – 1,2 V. Pravé poučení je však , že vratnost redox děje v rozmezí cca 0,2 přepětí nastáva jen při pomalém ději nabíjení 0,003 V/s. standardní potenciál 0,7 V v S24 pochopitelně není napětí celé slavné protonové baterie, ale jen její lépe se chovající BQ anody. Analýzy el. hmot pomocí SEM-EDX jsou obvykle málo přesné; podíly % teor./skut. pro dusík 6,12/2,09 či pro síru 5,54/6,25 jsou u dusíku varující.
Voltagramy S35-36 ukazují poměrně velká přepětí el. hmot a pokles vodivosti při redukci. Je z nich vidět, že použitelné napětí článku BQ elda – Nq el. = jen 0,35 V. S37b má na ose y chybu v jednotce pouhé 3 ř. .S38 se týká jen lepší BQ el. . Coulombic efficiency v S42c je pochopitelně 100%, protože při max. potenciálu na anodě pouhých 0,6 V k degradačním vedlejším reakcím dojít nemůže, na S42 je však jen 95%. Graf diferenciální kapacity S43 ukazuje, že při nabíjení či vybíjení se článek chová rozumně při 0,6 A/g , tj. při době cyklu cca 216 As/0,6A = 6 minut. I potom je hystereze potenciálu nabití a vybití cca 0,1 V. Rychlovka 5,5 A/g tj cyklus cca 40 s kapacitu i hysterezi již velmi kazí. Říkají, že ani protony již nestíhají. Pochopitelně se do hydrofobní matrice polymeru, hlavně NQ nemohou snadno dostat. V S48 před zázračným brutálním rychlonabitím protonového článku organickým solárním, /bohužel však nikoliv mikrovlnami či organickým supravodičem,/ ale jen mastňáckými Cu dráty sice píší že PV dávala 0,6 V při 6-10 mA, ale tajných odporech organik i protonů. S42b ukazuje mAh/g vs. mAh/g což samo je nesmysl i bez hodnot až do 500 mAh/g na ose x. S44a2 sice ukazuje napětí 0,488 V ale vlastně v ládovacím obvodu v nejasné době (kapacitě, odporech, proudu). Nicméně jasné jako Slunce je, že na org. PV svítí 1 sun. Graf b ukazuje vybíjení protonů při 3C, tj. během (216 mAs/mg)/3=72 mA po dobu 3 s. To by během 3 s nestačili asi proměřit na jednoduchém krabičkovém A, V metru a stopkách. Asi to mysleli a provedli jinak. Je však vidět, že využitelná energie spíše průměrně odpovídá jen 0,35 V*50 mAh/(gram slabší NQ). Odpory stále nikde. Chtělo to zatěžovací graf PV a nabíjení a vybíjení v grafu s proudy i s časem, aby nebyly hádankou přes spíše nejasné C. Z S46 je vidět že po 60,13 s display teploměru je nečitelný, vypočítat jeho spotřebu netřeba.
Nejvíc se jim povedla finta s udáváním kapacity 60 mAh/g NQ a zatajení napětí článku 0,35 V. Důvtipné je převedení malé kapacity a napětí prototypového coin článku na brutální protonový rychlonabíjecí a tím i rychlovybíjecí článek.
Apríl hodiny
Josef Hrncirik,2020-04-11 11:46:25
7 Wh/kg sestavy = pochopitelně též 7 mkWh. Automaticky intuitivní střelbou jsem to okamžitě navíc podělal 3,6. Čekal jsem, že už od francouzské revoluce jsou placeni od ks, spíše než /h.
Ampérhodiny ... a napětí?
Jiří Kocurek,2020-04-10 17:01:06
Hodnota 60 mAh/g (= 60Ah/kg) je nádherné číslo. Jenže něco jiného je 60 Ah při 12 V a něco jiného při 1,2 V. Dle grafů ve zdrojovém článku je napětí baterie 0,6 V a napětí rychle klesá k 0,5 V při 10% vybití. Což nám dává: 60 Ah x 0,5 V = 30 Wh = 0,030 kWh/kg, když dobře.
Pro srovnání: Olověná autobaterie s kapacitou 60 Ah váží celých 15 kg. Ale dodává 12 V, čili obsahuje 0,72 kWh energie. Nebo také 0,048 kWh/kg, v reálu o něco míň.
Jinak řečeno: S olověnou baterií stejné hmotnosti dojedete dál. A i ta olověná baterie je pro provoz vozidla nehorázně těžká, 1500 kg na 60-70 kWh je prostě moc.
Ovšem pozor
Vítek Běhan,2020-04-10 10:51:28
Článek univerzita zveřejnila 1. dubna, ale to ještě neznamená, že jde o apríl. Pokud si otevřete Angewandte chemie, dojde vám, že jde o zcela vážně míněný výzkum. A ten monočlánek je rovněž autentický. Než by se dělali s něčím novým, tak rozebrali několik lithiových a s pomocí těch dílů sestavili ten svůj.
Trochu pozdní apríl
Petr Chvátal,2020-04-10 08:57:14
No, nevím, ale publikovat aprílový článek až dneska?? Že je to apríl je vidět třeba už z první fotografie ... onen "Prototyp organické protonové baterie" je bežný Li-Ion knoflíkový akumulátor Lir2032. :-)
hustota
Petr Petr,2020-04-10 07:59:03
Nejde o malou kapacitu 60 mAh, ale o malou hustotu 60 mAh na gram.
Lithiové mají hustotu 200 až 600 mAh na gram, takže protonová baterie bude řádově objemější. Což ji prakticky vyřazuje jako mnoho jiných pokusů.
Re: hustota
Mojmir Kosco,2020-04-10 08:29:56
Treba záleží i na bezpecnem objemu takove baterie .do aut tedy ne ale jako zalohove baterie ?
Re: Re: hustota
Jan Balaban,2020-04-10 10:01:21
Pokojne existujú vedľa seba kanóny aj vzduchovky. Na vrabce je lepšia vzduchovka.
Re: Re: Re: hustota
Libor Zak,2020-04-10 12:13:53
A na ty co po vrabcích střílí, je zase lepší Glock. Navíc si nedovedu představit oblast, kde by byla tahle baterie lepší, než již existující řešení. Ale má to už v popisu slovo organické a dále čteme ekologiceké šetrnější. Takže za tím prostě budou granty vypláznuté za zbytečný výzkum. Ale třeba objeví něco, co se pak uplatní jinde. Moc tomu ale nevěřím, tohle smrdí účelovostí.
Re: Re: Re: Re: hustota
Jan Novák9,2020-04-10 13:30:04
Organické je v elektronice spíš nadávka. Ekologicky šetrnější to je jen v žádosti o grant a v reklamě. Organické znamená malou životnost.
Kolem roku 2000 panovalo nadšení nad tím jak drahé a neekologické LCD displeje budou do dvou let nahrazeny levnými a ekologickými organickými OLED displeji, tisknutýni na inkoustových tiskárnách.
Dnes o 20 let později oled sice máme ale levné rozhodně nejsou a o ekologii raději nikdo nemluví.
Co se baterií týká každých pár let je v laboratoři nějaká průlomová zázračná s desetinásobnou kapacitou a desetinovou dobíjecí dobou. Jenom v obchodě jaksi nejsou. To už je okoukané, je potřeba nasadit nové triky, a zkusit získat peníze (zase) přes ekologii.
Re: Re: hustota
Libor Zak,2020-04-10 12:16:07
Má to životnost 500 nabíjecích cyklů a malou kapacitu, co by se tím mělo zálohovat? Je to jasná účelovka na získání dotací z ekologických fondů.
Re: Re: Re: hustota
Ladislav Truska,2020-04-11 13:16:58
četli jsme stejný článek...? "Dosavadní testy ukazují, že baterie vydrží 500 cyklů vybití a opětovného dobití, ANIŽ BY DOŠLO k citelnému poklesu její kapacity."
Re: Re: Re: Re: hustota
Josef Hrncirik,2020-04-12 21:41:05
V článku se o článku jasně píše: Zevnitř pozlacený coin prototyp má kapacitu 216 mAs při 1 + 1 mg vodivých polymerních chinonů na 0,2 g destiček ze skelného uhlíku a neudaném separátoru ze skelné tkaniny a dává napětí cca 0,35 V.
Chlubí se tím, že solární článek ho proudem 8 mA a napětím 0,6 V nabije i bez elektroniky za 100 s a že jeho vybití do zkratu? proudem 3 mA lze provést za pouhých 72 s s 50% využitím nabíjecí energie.
Je to na nabytí nebo spíše na zabití?
Re: hustota
Josef Hrncirik,2020-04-10 14:30:12
Navíc lithiové dávají i více než 3 V/článek, zatímco organická protonová baterie dá jen 0,6 V. Vůbec se nedivím, že se tím nechlubí. Reakcí na organických elektrodách se zúčastňují protony z elektrolytu 5% H2SO4. Potom je ale 2 V Pb aku také (super)protonový článek.
Mor je!!!
Re: Re: hustota
Josef Hrncirik,2020-04-10 17:17:18
Hustotu pochopitelně udavači udávají/g aktivních elektrodových hmot.
I v Li článcích tvoří eldy max. 30% masy. (obal, přívody, separátor, elektrolyt, odvzdušnění, elektronika článku …).
Potom 60 mAh/g*0,35V = 21 Wh/kg akt. elektrod; = cca 7 Wh/kg sestavy = 1,94 mkWh/kg Superprotonového Organického Prazdroje.
Jak jsem přišel na 0,35 V? V samotném závěru článku o článku se udavači chlubí sice 0,4 V, ale z obr.S44 je to jen průměrně 0,35 V/cyklus vybití. Ukázka či popis cyklu nabytí nabití jsou tajní. Tvrdí ale, že nábojová účinnost je 100%. Nabíjecí a vybíjecí křivky pro rozumné rychlosti neuvedeny, ani odpor. V obr. S37b mají nejspíš kblbě osu y. Kapacita b) by byla naprosto nepoživatelná.
Vnitřní odpor baterie, účinnost cyklu nabíjení a vybíjení v různých režimech, nabíjecí a vybíjecí rychlost.
Josef Hrncirik,2020-04-18 23:01:56
V článku nejsou důvěryhodná data o jeho odporu a vhodné rychlosti nabíjení a vybíjení a účinnostech v různých režimech. Coin prototyp při 1 mg/Q hmot na eldě 0,5 cm2 měl kapacitu jen cca 216 mA.s a vnitřní odpor cca 50 ohm. Z voltametrických skenů nedošlo ani k polovičnímu nabití jednotlivých elektrod ani při nejpomalejším skenu 3 mV/s.
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce





