Stavebním kamenem objasňující mechanismus účinku léčiv se stala receptorová teorie. Po třicetiletém úsilí rozvíjejícím myšlenku ji v roce 1905 formuloval britský fyziolog John Newport Langley. Dnes již víme o tomto fundamentu opravdu hodně. Přesto pokračuje získávání dalších občas nenadálých poznatků. Nad některými, nadsázku stranou, ustrnou v němém úžasu i ti s farmakologickým vzděláním, jenž neudržují stálý kontakt s čelem vědeckého dění, nebo sami nejsou vědci. Pro někoho s neaktualizovaným paradigmatem bude například funkční selektivita v okamžiku seznámení připadat jako nadpřirozený jev s velkou mocí. Opravdu širší uplatnění tohoto principu by v obecné rovině znamenalo pro farmakoterapii potencionální převrat. Neomezoval by se pouze na vybranou lékovou skupinu nebo chorobu, zasáhl by každý kout oboru. Nemůžeme slíbit, že se očekávání naplní, ale poslední dobou vychází povzbudivé práce s čím dál vyšší frekvencí.
Funkční selektivita je relativně mladý fenomén. Poprvé vědci neobvyklé chování popsali v roce 1993 mezi variantami receptoru PACAP. V roce 1995 Terry Kenakin pro zaznamenaný jev, které nazval “agonist trafficking”, předložil hypotézy a všiml si jeho významu pro farmakoterapii. Jak začal stoupat počet prací dalších autorů, přibývala různá pojmenování toho samého. Větší oblibu si získal termín z roku 1998 “biased agonism” nebo-li “functional selectivity”. O co vlastně jde? Nejdříve bude nezbytné se něco dozvědět o receptorech.
Receptory
Ústřední bod v principu účinku farmak i hormonů náleží receptorům, což jsou rozličné chemické senzory ukotvené v buněčné membráně. Každý jednotlivý typ senzoru je vyladěn na monitorování konkrétního chemického signálu přicházejícího z mimobuněčného prostoru. Když se objeví mu adresovaná molekula (ligand), naváže se na něho. Zapadne jako klíč do zámku. Toto přirovnání vystihuje důležitost tvarové kompatibility receptoru (zámku) a ligandu (klíče). Zároveň z něho vyplývá, že molekuly odlišné struktury, ale podobného tvaru zapadnou do stejného zámku, čehož využívají léčiva, která klamou receptory, vydávajíc se v přestrojení za jejich přirozené ligandy (hormony).
Receptor si informaci o zachycení ligandu nenechává pro sebe. Posílá jí z povrchu do nitra buňky skrz signální kaskádu. K velmi častým partnerům, kteří přebírají povel od receptorů, jsou G proteiny. Jejich aktivace signál zesílí převedením na druhého posla, který jakmile udělá, co má, vyvolá biologický účinek. Tím může být zvýšení krevního tlaku, srdečního tepu a mobilizace zásobního glykogenu po vyplavení adrenalinu z nadledvin při bungee jumpingu či jiné stresové situaci. Nebo to může být chuťový či čichový vjem vyvolaný ligandy dodanými z vnějšku.
Funkční selektivita a farmakoterapie
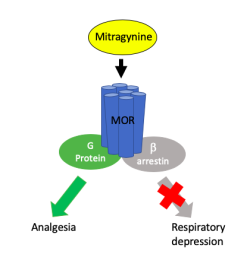
Receptory spřažené s G proteiny mají ještě jednoho paralelního proteinového společníka, který s nimi spolupracuje. Mnoho let byl protein beta-arrestin podceňován. Vědci si mysleli, že jeho jedinou funkcí je přetnutí signální cesty G proteinu za účelem modulace citlivosti receptoru ke stimulům. Dlouho se bral G protein za toho, kdo určuje druh reakce a beta-arrestin za někoho, kdo strká prsty leda tak do intenzity této reakce. Nicméně vyšlo najevo, že beta-arrestin kromě toho řídí nezávislou signální kaskádu s vlastním biologickým účinkem. Dříve opomíjený přicmrndávač rázem povýšil na důležitého hráče. Za vyvedení z tohoto omylu, aby také ne, udělila Královská švédská akademie věd v roce 2012 Nobelovu cenu za chemii.
Druhého omylu se vědci dopustili, když zastávali názor, že všechny aktivátory receptorů vyrovnaně zapínají G protein a beta-arrestin. Svou chybu neměli z čeho snadno poznat. Až na vzácné výjimky potvrzující pravidlo výsledný biologický efekt všech přirozených ligandů a léčiv opravdu vzniká rovnoměrným zapojením obou signálních drah. Toto pravidlo se zdálo být pevně předurčeno, jenže receptory chtě nechtě dostaly do vínku i zadní vrátka.
Po korekci omylů šla tradiční představa o receptorech z kola ven a nahradil ji princip funkční selektivity. Pojem se vykládá, jako možnost u daného receptoru ligandem selektivně zapnout konkrétní signální dráhu čili vybranou biologickou funkci. Ovládnutí uvedené schopnosti by se nám strašně moc hodilo k přesnějšímu zacílení ve farmakoterapii. Jak ale selektivně spustit dráhu, když obě naráz ovládá jeden spínač (receptor)?
Buněčné efektory jsou neuvěřitelně přístupné k manipulaci. Předání povelu na proteiny v buňce zajišťuje změna tvaru receptoru iniciovaná ligandem a model funkční selektivity připouští existenci aktivátorů, které transformují receptory do nespočtu různých tvarů. Některé interakce stabilizují uspořádání zaměřené buď na jedno, nebo druhé signální rameno. Měly by proto hypoteticky existovat ligandy pro všechny přechodové možnosti, jež přimějí receptor k širokému spektru reakcí od naprosto selektivní aktivace G proteinu či beta-arrestinu až po různý poměrový mix stimulace obou signálních drah. Stačí už jen takové ligandy, co provádí přínosné léčebné akce vypátrat.
To bude vskutku náročný úkol. Vědci nemohou stavět na zkušenostech s přirozenými ligandy. Musí teprve dešifrovat biologický význam izolovaných drah a u nalezených selektivních ligandů se musí přesvědčit, že jsou skutečně takové, jaké se jeví a projevené známky selektivity nepochází od jiných faktorů. Nic z toho není jednoduché, proto výzkum zřejmě okoření senzační úspěchy i zcela nečekaná zklamání. Dokonce nelze vyloučit přehodnocení, zde uvedených skutečností. Vždyť široké přijetí funkční selektivity vědeckou obcí za nepopiratelný fakt trvalo od zveřejnění důkazů takřka dvě desetiletí.
Namáhavé pachtění za ligandy a experimenty mapující biologický účinek oddělených drah badatelům nic neusnadní. Na veselosti jim ale přidává jedna zajímavá drobnost. Z toho co zatím víme, to matka příroda pěkně zařídila, všechna čest. Mnohdy žádaný účinek léku zprostředkovává jedna signální cesta a nechtěný druhá, i když ani jednu dráhu nelze označit za univerzálně škodlivou nebo prospěšnou. Být to jinak máme po legraci. Takhle lidská touha po pokroku dostala příležitost obohatit farmakoterapii o bezpečnější léčiva s vyšší účinností a menšími vedlejšími účinky.
Perspektivy funkční selektivity jsou dalekosáhlé. Uvědomíme-li si úctyhodný rozsah problematiky, není se čemu divit. Receptory spřažené s G proteiny zprostředkovávají většinu podstatných fyziologických funkcí, a proto okolo 50 % všech používaných léčiv obsazuje tyto receptory. Nadto se očekává, že paralelní signální dráhy nalezneme i u receptorů z jiných rodin spolupracujícími s odlišnými efektory, než jsou G proteiny. Označovat funkční selektivitu za zlatý grál farmakologie není ani trošičku přehnané.
Starý pes nové kousky
Ačkoliv cílené hledání vychýlených agonistů není triviální a vyžaduje komplexnější metody, známe již hodně zástupců. Vedle předtím neznámých tu najdeme i hrstku sloučenin v paletě zavedených léků. V době jejich uvedení na trh jsme například netušili, že účinek dvou antihypertenziv (carvedilolu a nebivololu) zesiluje vychýlení signalizace ve prospěch beta-arrestinu. Blokátory beta-1-adrenergního receptoru, kam carvedilol patří, slouží k léčbě vysokého krevního tlaku a nedostatečného výkonu srdeční pumpy. Jenže u srdeční nedostatečnosti se jejich efekt značně liší. Před odhalením asymetrie v signalizaci u carvedilolu vědcům vrtalo v hlavě, proč zrovna on dosahuje při posilování efektivity činnosti srdce nejlepších výsledků. Teď už téměř nepochybují, že přišli na hlavní příčinu.
Později si také uvědomili, když carvedilol stimuluje beta-arrestin adrenergních receptorů, tak bude umět i jiné kousky. A nespletli se. Kdybychom o signální odchylce nevěděli, nikoho by nenapadlo provádět test, který demonstroval zvýšení svalové síly a kontraktility kosterních svalů. Posilující vlastnost by přišla k užitku ve stáří, kdy svalstvo v pokročilém věku ubývá, což ohrožuje seniory vyšším rizikem pádu. Ve skutečnosti carvedilol na molekulární úrovni funguje na chlup stejně, jako nebezpečný sportovci nelegálně zneužívaný prostředek k podpoře budování svalů clenbuterol, protože však v kontrastu s ním blokuje G protein, neohrožuje uživatele výskytem závažných arytmií nebo vývojem srdečních chorob.
Cíle pro funkční selektivitu
Funkční selektivita vyřešila záhadu carvedilolu, ale i dala nový impuls pro objevování léků. V rámci osvojování konceptu se čile prověřuje užitečnost selektivního ovlivnění receptorů souvisejících s léčbou diabetu, osteoporózy, deprese, úzkosti, schizofrenie, bolesti, srdečního selhání a dalších chorob. V některých oblastech navržené léky již proběhly cílovou páskou. Vývoj v tomto roce završil tirzepatid regulující hladinu krevního cukru. Oproti předchozím antidiabetikům stejné skupiny (aktivátory GLP-1 receptoru) vyniká ve schopnosti normalizovat tělesnou hmotnost u obézních pacientů. Ostatní zkoumané selektivní ligandy jsou v mnohem ranějších fázích výzkumu. K nadějným patří například tabernathalog a AAZ-A-154. Tyto látky zřejmě udělají díru do světa v léčbě deprese a závislostí. Předvedly, že umí napodobit antidepresivní akci psychedelik, aniž by vyvolaly nežádoucí halucinace.
Jedním z posledních objektů poctěným zájmem vědců se stal beta-2 adrenergní receptor. Jejich aktivátory obsažené v inhalátorech uvolňují dusivé sevření hladkého svalstva dýchacích cest. Zachraňují životy při astmatickém záchvatu, zároveň slouží i k jeho předcházení a také zlepšují kvalitu života osob s chronickou obstrukční plicní chorobou. Účinek těchto důležitých léků oslabuje znecitlivění receptoru po zapojení beta-arrestinu. Vzniká takzvaná tachyfylaxe, což je rychle vznikající návyk po opakovaných dávkách, když ještě nedošlo ke kompletnímu vymizení léku z organismu. Tým badatelů z University of South Florida zkusil problém tachyfylaxe odstranit. Prohledal 40 milionů sloučenin a uspěl. Ze všech nalezl jednu jedinou, u které nezachytil pozorovatelný sklon k vyvolání návyku. Už chystají další zkoušky, aby prokázali, zda se jedná o vhodného kandidáta pro klinický vývoj.
Bezpečnější opioidy
Kdyby měla být vybrána a vyzdvižena jedna oblast, kde by funkční selektivita vnesla výrazný prospěch, byly by to látky vázající se na podtyp opioidního receptoru mí určené k potlačení bolesti. Od neolitu lidstvem tradičně využívané a zneužívané opioidy netřeba asi sáhodlouze představovat. Každý ví, že jsou dobrým sluhou zlým pánem. Tvář Mr. Hyda ukazují, když při nevhodné aplikaci nabudí neurony ve ventrální tegmentální oblasti mozku pro odměnu s razancí, která se nevyrovná jiným přirozeným radostem, co život nabízí. Proto oplývají vysokým potenciálem ke zneužívání. Medicína se však zatím bez nich neobejde. Navzdory neutuchající snaze najít alternativu představují dosud nejsilnější dostupný prostředek k tlumení silné akutní bolesti.
Pomineme-li sklon ke zneužívání, potřebu nahradit klasické opioidy ospravedlňují i vedlejší účinky při lékařsky oprávněné ordinaci. K opatrnosti nutí především snížení dráždivosti dechového centra, jež se projeví zpomalením dýchání, které při předávkování vede k zástavě dechu. Na závažný útlum respirace si musí dát pozor lékaři v nemocnicích, kde se sčítá účinek anestetik a dalších léků. Ambulantních pacientů při dodržení správného postupu léčby by se tolik týkat neměl.
O poznání nepříjemnější komplikace ze subjektivního pohledu se dostavuje při delším podávání. Pacienty často sužuje zpomalení motility střev doprovázené zácpou. Někdy až úporná zácpa bývá stejně, ne-li více deprimující než samotná bolest. Nebylo tomu tak odjakživa. Naštěstí dnes mají lékaři ve zvyku léčbu opioidy kombinovat s periferními blokátory opioidních receptoru, které chrání střeva před paralýzou a nenarušují analgetický efekt.
Pokusy o odstranění nedostatků opiátů proběhly hned, jak jsme dovedli chemicky modifikovat přírodní alkaloidy z máku. Ozvěny jedné takové rádoby přelomové úpravy se nám vrací doposud. Dnes nám to připadá úsměvné, ale na přelomu století německá farmaceutická společnost Bayer ve vší vážnosti přesvědčovala zákazníky z řad morfinistů o nenávykovosti heroinu.
Selhání neodradila chemiky od pokračování v modifikacích, jimiž zjednodušili skelet morfinových alkaloidů. Připraveno bylo nepřeberné množství derivátů, které ukazovaly, že jsou mezi nimi rozdíly, žádný však nevynikal nad ostatními, ať byla snaha sebevětší. Bezradnost v dalším postupu zahnalo v roce 2005 studium zvířat s knockoutovaným genem pro beta-arrestin opioidního receptoru. Od té doby do dnešních dnů provedené experimenty většinou dokládají, že se lze vyhnout dechovému útlumu, zmírnit zpomalení střevní pasáže a nevolnost, pokud se k léčbě bolesti nasadí funkčně selektivní opioid zaměřený na G protein.
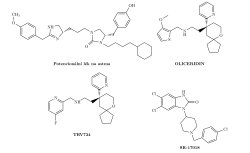
Medicína se ho dočkala v roce 2020, kdy byl ve Spojených státech amerických na druhý pokus schválen oliceridin určený pro pacienty v nemocniční péči. Navzdory nezpochybnitelné kvalitě oliceridinu se první zástupce svého druhu nepředvedl v nejlepším světle. Na myších vykazoval fantastické výsledky. V klinických testech už tak slavně nedopadl. V nejnižší zvolené dávce se skutečně choval podle předpokladu a působil menší respirační útlum než morfium. Jenže ve vyšších dávkách jeho výhoda zmizela. Vinu za to vědci kladou malému odstupu v aktivaci drah. Položíme-li jedničku rovnou vyrovnané aktivaci G proteinu a beta-arrestinu, pak morfinu a fentanylu bude náležet hodnota jedna a oliceridinu patřit číslo tři, přitom některé experimentální látky ze série SR se pyšní téměř absolutní selektivitou. Realizovat sliby, proto leží na následovnících oliceridinu.
Funkční selektivita a tolerance na opioidy
Zařadit do výzbroje opioidy s čistější selektivitou se vyplatí kromě bezpečnosti ještě z důvodu omezení vzniku tolerance. Již bylo předesláno, že beta-arrestin tlumí dráhu G proteinu a tím přispívá k částečné ztrátě citlivosti buněk k ligandům. Za dějem stojí jak rozpojení dráhy uvnitř buněk, tak snížení koncentrace receptorů na povrchu buněk. Když to nastane, klesne vliv na nervovou soustavu. Aby se zachovala ekvivalentní potence, je nezbytné dávku zvýšit. Proto pacienti a zejména lidé zneužívající opioidy si mohou vypěstovat návyk, který uspokojí dávka, co by člověka “neotuženého” sprovodila ze světa. Podle pokusů s experimentální látkou SR-17018 tomu selektivní opioidy zabrání a mnohem víc. Přechod z klasických na vylepšené medikamenty by zvrátil už existující toleranci.
Patrně tak máme na dosah zhmotnění snu o nenávykových opioidech, které udržují stále stejnou mohutnost analgezie nezávisle na době trvání léčby. Pokud se opravdu vize splní, současně získáme prostředek na zvládání abstinenčních symptomů u závislých osob. Výměnou klasického opioidů za selektivní by měla být docílena obnova citlivosti neuronů a poté bude snadné lék vysadit. Takto uvažuje společnost Trevena, jež přišla s oliceridinem a teď by chtěla nasadit jeho analog TRV734 do boje s opiátovou krizí ve Spojených státech amerických.
Jejich iniciativa si zaslouží komentář, jenž zpochybňuje vhodnost takového počínání. V další rovině problému se z chování zvířat zdá, že selektivní aktivace navozuje stav, který se pokusným myším zamlouvá víc než ovlivnění navozené neselektivní stimulací. Rozhodně to podporuje obavu, zda se z takového léku na závislost nestane heroin 21. století. Kdo by neupřednostnil k uživateli přívětivou alternativu heroinu, co vás dostane tam kam on a možná ještě dál?
Závěr
Receptory jsme se zprvu naučili chápat jako číslicovou techniku, která má dvě hodnoty vypnuto a zapnuto. Postupně se ukazovalo, že to je s nimi poněkud složitější. Našly se ligandy, které receptory zapínají částečně, a dokonce takové, jenž vypnutý receptor přesouvají do polohy ještě více vypnuté. Jakoby toho nebylo málo, nakonec se smiřujeme s ligandy, co zapínají u jednoho receptoru různé výstupy, což nám dovoluje ušít lék na míru.
Poznámka: Pokud chcete vědět, proč by odborníky se zažitým starším paradigmatem biased agonismus vyvedl z míry, přečtěte si následující vysvětlení. Nejprve, aby bylo jasno v terminologii. Agonista je aktivátor biologického účinku a antagonista biologický účinek agonisty blokuje. Agonista/antagonista jsou jednoduché a pevně definované pojmy, pilíře odborného vyjadřování. Jenže funkční selektivita s jednoduchostí nemilosrdně otřásla. Jak přesně zamíchala s kartami? Představte si následující situaci, kdy biased agonista aktivuje výlučně dráhu G proteinu. Zde zůstává všechno při starém. V původním a aktualizovaném pohledu se jeví ligand shodně jako agonista. Na druhou stranu agonista jednostranně zaměřený na beta-arrestin se v minulém řádu považoval za antagonistu. Dlouho omílané tradiční pojetí se hroutí. Dokonce známe i příklad. Carvedilol lék předepisovaný při srdečním selhání blokuje beta-1 adrenergní receptor. V dané indikaci je účinnější než jiné léky z téže skupiny. V roce 2007 se přišlo na to, že výhoda nad ostatními beta-blokátory zřejmě plyne z bonusové stimulace beta-arrestinu. Lék který házíme do stejného pytle s ostatními antagonisty beta-1A receptoru, tedy doopravdy žádným antagonistou není. Jedná se o biased agonistu.
Literatura:
DOI: 10.1016/s0165-6147(00)89032-x
DOI: 10.1038/365170a0
DOI: 10.1073/pnas.2026668118
DOI: 10.1073/pnas.1920310117
DOI: 10.1371/journal.pone.0071980
DOI: 10.1124/jpet.112.201616
DOI: 10.1111/dom.14775
DOI: 10.1038 / s41586-020-3008-z
DOI: 10.1016/j.cell.2021.03.043
DOI: 10.1038/s41386-019-0491-8
DOI: 10.1016/j.neuropharm.2020.108439
DOI: 10.1016/j.tips.2018.08.007
DOI: 10.3389/fpain.2021.722820
Kratom
Autor: Miloslav Pouzar (28.05.2019)
Houbičky a LSD versus alkohol, kokain,…
Autor: Josef Pazdera (21.01.2020)
Jaký halucinogen se nejlépe hodí k terapeutickým účelům?
Autor: Václav Diopan (22.01.2020)
Deuterium: Staronová finta farmaceutických chemiků
Autor: Václav Diopan (06.12.2020)
Lze léčit přetrvávající potíže po lymeské borelióze?
Autor: Václav Diopan (24.01.2021)
Lysohlávka jako příležitostný lidský patogen
Autor: Václav Diopan (01.06.2021)
Diskuze:






