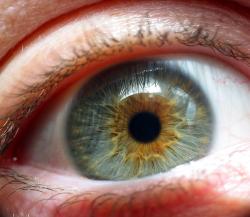
Podle článku, který zveřejnil renomovaný časopis Cell, vědci na myších modelech zjistili, že určitá genetická porucha způsobující postupnou ztrátu zraku narušuje také určité mechanizmy obranyschopnosti organismu. Ty pak umožňují bakteriím ze střeva krevním řečištěm doputovat do oka a napadnout nemocí poškozené buňky sítnice. Patogeny tak mají na svědomí její sekundární degeneraci, čímž výrazně dopomohou k úplné slepotě.
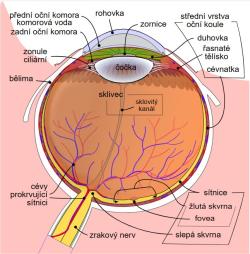
Vědci zkoumali důsledky mutací v genu CRB1 (Crumbs homolog 1), který je aktivní v pigmentovém epitelu sítnice – protein, jenž gen kóduje, se nachází v buňkách fotoreceptorů. Mutací pozměněné formy (alely) genu CRB1 jsou příčinou asi 7 % všech případů onemocnění na pigmentovou retinitidu (retinitis pigmentosa) – geneticky podmíněného regresivního poškození buněk (dystrofie) sítnice. Podílejí se také na asi 10 procentech výskytů Leberovy vrozené slepoty (Leberovy kongenitální amaurózy).
Jenže gen GRB1 je aktivní také v zcela jiné povrchové tkáni – ve výstelce hrubého střeva, kde se jím kódovaný protein podílí na fungování epitelové bariéry, na regulaci, co se přes ni dostává do krve. A to je životně důležité vzhledem na obsah střev osídleného biliony bakterií. Vědci na myších prokázali, že mutace v genu CRB1 sníží jeho aktivitu, tedy i produkci příslušného proteinu. Střevní epiteliální bariéru to oslabí natolik, že některé škodlivé bakterie se přes ni propašují do krve a s ní pak putují až do oka a způsobují sekundární degeneraci silně prokrvené sítnice. Tu navíc poškozují stejné mutace genu CRB1, jež zapříčiňují zmíněná vrozená onemocnění zraku.
|
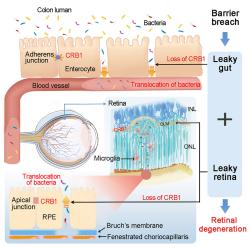
Mutace v genu CRB1 (Crumbs homolog 1) způsobuje nedostatek proteinu, který kóduje v epitelu střeva i sítnice. To oslabí obrannou bariéru a způsobí její propustnost pro bakterie, které se ze střeva dostávají do krve a v ní putují až k sítnici. Kredit: Peng, Shanzhen et al., Cell, Volume 187, Issue 6, 1387 - 1401.e13
|
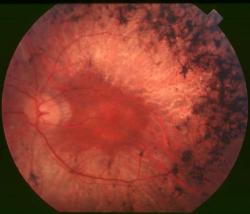
Dobrou zprávou zmírňující vliv Černého Petra v kartách genetického dědictví je, že proti škodlivým bakteriím účinkují antimikrobiální léky, nejčastěji antibiotika. Ve studii dokázaly u myší zabránit úplné ztrátě zraku. Jestli stejné mechanizmy fungují i u lidí se prokáže v další fázi výzkumu. Nicméně antibiotika příčinu neřeší, pouze část důsledků nemoci. Stav nezlepší, jen zpomalí jeho zhoršování. Radikálnější a nadějnější volbu představuje genová terapie, jež se rychle rozvíjí. Například v loňském roce publikovaná americká studie (zde) provedená také na myších s mutací způsobující pigmentovou retinitidu prokázala, že když se genová terapie aplikuje v raných fázích choroby, kdy ještě není poškozen nadpoloviční počet tyčinek, pak „léčba obnovuje produkci sítnice na úroveň blízkou divokému typu“. Jim se označují zdraví hlodavci bez cíleně indukovaných genetických mutací imitujících lidské vrozené nemoci. Připomeňme, že tyčinky jsou typem fotoreceptorů v oční sítnici, které reagují i za šera na slabé světlo, ale nerozlišují jeho vlnovou délku, tedy barvu. Tu vnímáme pomocí tří typů čípků, které degenerace postihuje o něco později.
Příkladem rozvoje genové terapie Leberovy vrozené amaurózy je již 3. fáze klinické studie (zde). Nicméně i při takové moderní léčbě je nový poznatek o možné a donedávna neodhalené přítomnosti střevních bakterií v sítnici oka nanejvýš důležitý.
Video: Retinitis Pigmentosa (pigmentová retinitida) – genetika, patofyziologie, příznaky a symptomy, diagnostika, léčba.
Literatura
I v buňkách oka je dobré některé materiály prohnat skartovačkou
Autor: Josef Pazdera (08.05.2018)
První neléková, nechirurgická a dlouhodobě účinná léčba glaukomu
Autor: Josef Pazdera (20.12.2020)
Diskuze: