V boji s rakovinou se uplatňuje řada jaderných metod. Velmi široce se využívají v oblasti diagnostiky nádorů, ale existuje i řada možností pro terapii. Tedy způsobů jak pomocí jaderné fyziky nádory zničit. Ve svém dnešním povídání bych se zaměřil na využití urychlovačů v tomto oboru medicíny a to hlavně urychlovačů protonů a lehkých jader. Ještě než se k tomuto tématu dostanu, zmíním se aspoň trochu o možnostech jaderných zobrazovacích metod v diagnostice nádorů.
Jaderné metody v diagnostice.
Základním principem této metody je, že se radioaktivní jádro vpraví do chemické sloučeniny, která se koncentruje v částech těla, které chceme zkoumat. V případě nádorů se nejčastěji využívá glukóza. Rakovinné buňky jsou totiž velmi aktivní a potřebují hodně energie. Právě glukóza je látka, která v těle energii distribuuje. Dochází tak k tomu, že se glukóza s radioaktivním jádrem koncentruje v nádoru. Při svém rozpadu pak toto jádro vyzáří i záření gama, které můžeme pomocí detektoru pozorovat a zmapovat tak polohu a rozměr nádoru. Pro detekci záření gama existují dva typy detektorů. Polovodičové detektory mají velmi dobré energetické rozlišení a menší detekční účinnost. Scintilační detektory pak velmi vysokou účinnost ale horší energetické rozlišení. V našem případě máme známou energii záření gama a nepotřebujeme mít perfektní energetické rozlišení. Naopak účinnost detektoru je třeba mít co největší, aby pro dobré zobrazení nádoru stačila co nejmenší radioaktivita. Proto je většina kamer používaných k tomuto druhu diagnostiky vybavena scintilačními detektory.
Snahou o co nejmenší zatížení pacienta aktivitou se řídí i výběr použitého radioizotopu (pochopitelně, že zde fungují i další aspekty výběru). Poločas rozpadu radioizotopu nesmí být příliš krátký, aby se stihla chemická látka značená radioizotopem připravit. Nesmí však být příliš dlouhý, aby aktivita neozařovala pacienta zbytečně dlouho po vyšetření. Proto jsou nejvhodnější radioizotopy s poločasem rozpadu několika hodin. Ovšem pak musí být jeho výroba a distribuce velmi dobře načasovaná. Vhodné radioizotopy se produkují i v našem ústavu s využitím cyklotronu, který zde funguje. Urychlovač produkuje přes noc ozařováním vhodného terče příslušný radioizotop. Velmi brzy ráno nastupují chemici, kteří připraví v biologicky čistých prostorách příslušné sloučeniny a odměří dávky s přesně definovanou aktivitou. Ta musí být nastavena tak, že se počítá s poklesem její intenzity během dopravy k pacientovi. A pak začíná závod s časem. Připravené dávky se naloží do auta a vezou se do příslušných nemocnic. Tam jsou na dohodnutou hodinu pozváni pacienti na příslušné vyšetření. Špatné je, když pak dojde k nějaké dopravní kalamitě. Pokud dojde k několikahodinovému zpoždění, jako tomu bylo nedávno na dálnici D1, nemusí už auto do cíle jezdit a vrací se zpět, protože už je aktivita příliš nízká.
Pozitronová emisní tomografie
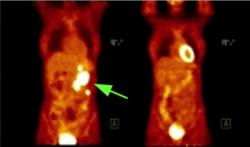
Velice významným druhem této diagnostiky je pak pozitronová emisní tomografie (PET). V tomto případě je radioizotopem zářič s beta plus typem radioaktivity. Při takovém rozpadu se vyzařuje pozitron, což antihmotný partner elektronu. Ten se v tkáni velice rychle zastaví a anihiluje s elektronem. Při této anihilaci vznikají díky zákonům zachování energie a hybnosti dva fotony, přičemž oba mají energii rovnou klidové energii elektronu (pozitronu). Pro hnidopichy ještě poznamenám, že mohou vzniknout i tři fotony (energie dvojnásobku klidové energie elektronu se mezi ně rozdělí), ale jen v zanedbatelném počtu případů. Pokud vzniknou dva fotony letí každý přesně v opačném směru. Ze směru příletu a doby letu fotonů k detektorům pak můžeme zjistit místo anihilace s milimetrovou přesností. Pozitronová emisní tomografie tak umožňuje získat třírozměrný obraz nádoru, zjistit jeho přesnou velikost, polohu a připravit postupy pro jeho zničení. O této metodě jsem se zmínil rozsáhleji, protože nám umožňuje i průběžné sledování výsledku ozařování nádorů těžkými ionty, kterému se chci hlavně věnovat.
Jaderné metody na ničení nádorů
Máme provedenu diagnostiku a určenu přesnou lokalizaci a velikost nádoru. Jaké jaderné metody můžeme proti němu využít? Lze je zhruba rozdělit do dvou skupin. Jde jednak o využití ozařování z vnějších zdrojů. Tímto zářením může být záření gama, elektrony nebo protony i těžší jádra. Druhou možností je, že podobně jako při diagnostické metodě dopravíme radioizotop na příslušné místo uvnitř těla. V tomto případě však musí být aktivita daleko vyšší než u diagnostiky. Existuje i metoda, která využívá současně oba procesy. Do nádoru dopravíme přesně dané neradioaktivní jádro, které se pak záchytem neutronů při ozáření neutrony z reaktoru nebo jiného zdroje změní na radioaktivní a svou aktivitou ničí rakovinné buňky. Podívejme se na jednotlivé metody podrobněji.
Ozařování zářením gama
Nejznámější a nejčastější je ozařování pomocí záření gama. Většinou se jako zdroj fotonů gama využívá radioaktivní rozpad a velmi často jde o rozpad izotopu kobalt 60. Jde například o známou kobaltovou bombu. Nevýhodou použití záření gama je, že při průchodu tkání jeho intenzita ubývá exponenciálně s hloubkou. Pokud je nádor někde uvnitř, je ozáření zdravé tkáně větší než rakovinné. V tomto případě se využívá toho, že rakovinné buňky jsou daleko citlivější než zdravé a k jejich zničení stačí menší intenzita záření. S výhodou se dá také provést ozařování z více směrů tak, aby se směry ozařování křížily v místě nádoru. Zdravá tkáň je tak ozářena jen jednou a nádor pokaždé. Velmi účinné je pak zařízení, které může ozařovat z mnoha směrů najednou a lze sestavit program ozařování tak, aby byl nádor ozářen co nejvíce a zdravá tkáň co nejméně. Takovým značně komplikovaným ale i účinným zařízením je i Leksellův gama nůž, který je díky celonárodní sbírce už patnáct let i v Česku. K jeho výročí napsal moc pěkné povídání iniciátor této sbírky František Janouch. Leksellův gama nůž má 201 nezávislých kobaltových zdrojů záření gama. Jen na tomto českém zařízení se provádí 800 operací pacientů ročně. Zákroky s využitím záření gama se využívají k boji s nádory velmi intenzivně a jejich roční počet je v celosvětovém měřítku v řádech milionů a jen těžko bychom jej přesně spočítali.
Rentgenové a gama záření můžeme produkovat i jako brzdné záření pomocí urychlovače elektronů a jak tyto fotony tak elektrony jsou využívány k ozařování nádorů. Elektrony mají při ozařování nádoru v hloubce stejný problém jako gama záření. Ozáření zdravé tkáně před nádorem je stejné nebo větší než tkáně nádorové. Navíc se díky velkým úhlům rozptylu elektronů, které mohou nastat, stává problémem přesná lokalizace ozáření. V řadě fyzikálních a biologických vlastností se záření gama a elektrony liší a při možnosti výběru mezi nimi je třeba pečlivě vážit podle typu pacientova nádorů a vlastností obou druhů záření.
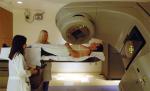
V předminulém roce slavila Stanfordská universita v San Francisku (USA) padesát let začátku využívání lineárních urychlovačů elektronů k boji s nádory. Její lékařský urychlovač nebyl sice úplně první, protože jej o tři roky předběhla Evropa, konkrétně Anglie. Přesto je to ten, který rozhodující měrou přispěl k obrovskému využití těchto zařízení. Elektrony urychlené tímto urychlovačem produkovaly rentgenové záření, které mohlo být velmi přesně zacílené a jen to umožnilo zlikvidovat nádor zasahující zbývající funkční oko dvouletého chlapce, bez toho, aby byla poškozena jeho funkčnost. To umožnilo v roce 1956 zachránit zrak u tohoto prvního pacienta. Dnes jsou tyto urychlovače velice flexibilní zařízení umožňující využití několika energií rentgenového záření i elektronů a nastavení nejvhodnějšího režimu ozařování pro daný nádor. Umožňují velmi přesné zacílení svazku a průběžné korekce na pohyb těch pacientových orgánů, které nelze fixovat. Odhaduje se, že počet pacientů léčených těmito zařízeními se za celou dobu jejich využívání blíží ke stovce milionů a v současnosti jejich počet představuje zhruba polovinu celkově ozařovaných pacientů.
Neutronová záchytová terapie

Zatímco ozařování pomocí záření gama a lineárních urychlovačů elektronů je velmi dobře zavedenou a široce využívanou metodou, je využití neutronové záchytové terapie stále teprve v experimentálním stadiu. V Japonsku už sice proběhlo několik stovek ozařování a jejich výsledky jsou docela slibné. Zatím však ještě nelze odhadnout, kdy se metoda z experimentální přemění na standardní klinickou. Je založena na skutečnosti, že alfa částice i těžší jádra svou kinetickou energii předají tkáni během velmi krátké dráhy a velmi účinně ničí rakovinné buňky. Problémem je, jak dostat zdroj částic alfa na místo uvnitř organismu. Takovou možností je, že do nádoru dopravíme neradioaktivní jádro bóru. Bór má dva stabilní izotopy. Z nich nás zajímá bór 10, kterého je v přírodě zhruba 20%. Má zároveň velmi vysokou pravděpodobnost záchytu neutronu za vzniku složeného jádra izotopu bóru 11. To se okamžitě rozpadá na jádro lithium 7 a částici alfa. Ty mají už zmíněný velmi krátký dolet v materiálu, takže deponují svou energii přímo v rakovinné buňce a velice efektivně ji ničí. Pacientovi, kterému byl bór pomocí vhodné sloučeniny dopraven do nádoru, je tento nádor ozářen pomocí neutronového svazku vyvedeného z reaktoru a pomocí zmíněných reakcí neutronů s bórem se ničí buňky nádoru. Tato metoda se zkouší i v Ústavu jaderného výzkumu a.s. v Řeži s využitím reaktoru LVR-15. První ozařování proběhlo v roce 2000 a pokud vím, zatím se zde takto léčilo pět pacientů.
Co to je hadronová případně protonová terapie?
A teď už ke slíbenému využití urychlovačů urychlujících těžší částice než elektrony. V tomto případě se ozařování provádí pomocí těžkých nabitých částic, patřících mezi hadrony. Tyto částice jsou urychleny na velmi vysoké rychlosti (energie). Nejčastěji se využívají protony, i když se využívají třeba i mezony pí. V čem spočívá výhoda použití těchto částic? Je dána způsobem jakým různé částice interagují s hmotou. Lehké částice foton nebo elektron mohou předat při srážce s elektronem v obalu atomu velmi velkou část své energie nebo úplně změnit směr svého letu. Foton při fotoefektu veškerou a při comptonovském rozptylu část, elektron při coulombovském rozptylu část. Naopak těžké hadrony, jako je třeba proton, předávají při takových srážkách jen velmi malou část energie a jejich směr letu se mění jen minimálně. Je to dáno čistě zákony zachování energie a hybnosti, tedy kinematikou srážky. Jestliže srážíme v kulečníku stejně těžké koule, předávají si i velmi velkou část energie a mohou i drasticky změnit svoji dráhu. Jestliže bychom vzali velmi těžkou kouli, měnila by při srážce s lehkými koulemi svoji dráhu minimálně. Hadrony tak při průchodu tkání ztrácejí energii postupně a pokud mají stejnou kinetickou energii, tak všechny doletí do zhruba stejného místa.
Ztráty energie protonů jsou způsobeny tím, že ji předávají zmíněným elektronům, vyrážejí je z atomů a způsobují tak ionizaci. Velikost těchto ionizačních ztrát velmi silně závisí na rychlostí.

Při velmi vysoké rychlosti jsou malé. Pokud však rychlost částice klesne pod nějakou hodnotu, velice rychle narostou a částice se velmi rychle zastaví. Většinu své energii tak deponuje v jednom místě. Svazek protonu tak během svého průchodu materiálem předává jen velmi malou část energie, většinu ji odevzdá při svém zastavení. Obrovskou výhodou je také, že místo tohoto zastavení je přesně dáno energií částic a změnou energie svazku je můžeme měnit. Magnetickým polem pak můžeme měnit směr letu částice. Velmi přesně tak můžeme energii zacílit do daného místa a postupně nádor velice přesně „vypálit“ s minimálními zásahy do zdravé tkáně.
Využití protonů pro ozařování nádorů bylo sice zavedeno do medicíny už v roce 1954, ale stále není běžnou záležitostí a takových zařízení není ve světě mnoho. Problémem je, že urychlovač protonů na velmi vysoké energie (jejich kinetická energie je zhruba okolo desetiny jejich klidové energie) je náročné a drahé zařízení. Proto jsou často taková ozařovací pracoviště v experimentálním režimu na urychlovačích, které jsou primárně určeny pro jiné účely. Takové pracoviště je například v Spojeném ústavu jaderných výzkumu v Dubně (Rusko) na urychlovači, na který jezdíme se studenty spolupracovat na experimentech s transmutacemi jaderného odpadu. Existují sice i specializovaná pracoviště při nemocnicích. První takové bylo otevřeno v roce 1990 a nyní je jich v USA pět. Příkladem je i šesté nově budované Robertsovo středisko pro protonovou terapii při Universitě v Pennsylvanii, které má po svém otevření v roce 2009 léčit 3000 pacientů ročně. Přesto se odhaduje že protonovou terapii ve světě podstoupilo do současnosti zatím jen zhruba 55000 pacientů, což je zlomek těch, kteří byli léčeni zářením gama nebo elektrony.

Je to zároveň mnohem méně než by bylo potřeba. Odhaduje se, že použití ozařování protony nebo těžkými ionty (o kterých bude více za chvíli) je vhodné zhruba pro 5 – 10% pacientů s rakovinou. Jde o případy, kdy se nádor nachází hluboko a je dobře lokalizován. Týká se to hlavně nádorů na mozku, kde může být každé i sebemenší poškození zdravé tkáně okolo nádoru kritické.
Ozařování těžkými ionty
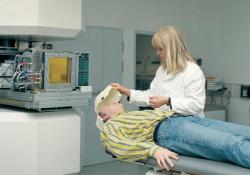
Ještě výhodnější než protony, jsou těžké ionty. Jako těžké ionty se označují všechny atomy těžší než vodík zbavené alespoň části elektronů. Ty mají ještě větší rozdíl mezi energiemi, které ztrácejí během průletu tkání a v místě svého zastavení. Zdravá tkáň je tak zasažená ještě méně a účinky na rakovinné buňky jsou ještě více zničující. Těžké ionty jsou zhruba třikrát efektivnější než protony. Ozařování pomocí iontů může být ještě přesněji zacílené a i tím ještě šetrnější. Další výhodou může být využití speciálního svazku. Například iontů uhlíku 12C. U něho některé z jader při své interakci s materiálem, kterým prochází, ztratí neutrony a přemění se i na jádra, která jsou beta plus radioaktivní a vyzáří při přeměně pozitron. Můžeme tak využít PET kameru k přesnému průběžnému sledování místa, kde se ionty zastavují a zda je vše v pořádku. Zmenšuje se tak riziko chyby a snižuje riziko pro pacienta.
Terapie těžkými ionty má obrovské výhody hlavně u mozkových nádorů u dětí. Tyto nádory jsou velmi dobře lokalizovány a ozařování ionty je může velmi efektivně zničit s minimální zátěží pro zdravou tkáň. Obrovskou výhodou je, že léčba nemá žádné nežádoucí vedlejší účinky. Pacient nepociťuje při ozařování a ani po něm žádnou bolest a nemá žádné problémy, které by souvisely se zákrokem. Velmi důležitá je hlavně u dětských pacientů psychická příprava a vytvoření co nejpřívětivějších podmínek, které by jim pomohly překonat strach ze „studené“ techniky okolo. Proto je důležité, aby pro ně lékaři i ostatní personál vytvořili co nejpřátelštější pohodovou atmosféru.
Ve Výzkumném ústavu GSI (Geselsschaft fűr SchwerIonenforschung) v Darmstadtu byl začátkem devadesátých let dokončen velký urychlovač těžkých iontů, který umožňuje urychlovat ionty až po uran na kinetické energie, které mají velikost srovnatelnou s jejich klidovou energií spojenou s jejich hmotností. Urychlovač je zaměřen na studium srážek těžkých jader, při kterých vzniká velmi hustá a horká jaderná hmota. Na tomto studiu, který nám umožňuje poznat stav hmoty na počátku vesmíru nebo uvnitř supernov, se od počátku práce tohoto urychlovače podílí i naše skupina z ÚJF AVČR. O těchto výzkumech si můžete přečíst například zde. http://hp.ujf.cas.cz/~wagner/popclan/hades/hadesvesmir.pdf Postavil se domeček s pokoji, kde by mohli lékaři v klidu a pohodlí připravit pacienty na zákrok.
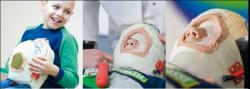
Sestavilo se zařízení samotného ozařovacího pracoviště: vývod svazku a přístroje pro jeho měření, fixační lehátko, PET kamera pro průběžnou kontrolu a spousta dalších přístrojů.

Od roku 1997 začalo toto pracoviště ozařovat. Většinou léčení probíhalo ambulantně ozařováním trvajícím okolo půl hodiny v každém ze zhruba dvaceti po sobě následujících dní. A tak se začalo stávat, že v některých obdobích naše experimenty probíhaly přes noc a přes den pracoval urychlovač pro lékařské účely. Když se pak člověk po noční směně ráno ubíral na kutě, musel myslet na pacienty a aspoň držet palce. Aby urychlovač fungoval co nejlépe, aby ozáření dopadlo na výbornou a aby byl nádor odstraněn. Byl to pak moc fajn pocit, když jsem po pár letech uviděl pořad v německé televizi, kde ukázali několik konkrétních případů malých pacientů, u kterých už bylo jasné, že rakovina zde byla poražena. Neměl jsem na tom žádnou zásluhu, ale už to, že jsem toho byl divákem, hřálo u srdce.
Jak tedy samotné léčení konkrétně probíhá? Popis je už upraven podle průběhu, který bude u dobudovávaného pracoviště v Heidelbergu, o kterém se rozepíši za chvíli. Nejdříve je pomocí moderních zobrazovacích metod PET, CT (počítačová tomografie) a MRI (zobrazení pomocí magnetické rezonance) určena přesná poloha a rozložení nádoru. Aby byla zajištěna přesná definice polohy, připravují se prostředky k fixaci pacienta (maska, upevnění ...) individuálně. Podle změřených hodnot polohy nádorů se připraví počítačový program pro řízení ozařování. Je snaha dosáhnout přesnosti definování polohy menší než milimetr. Provede se ještě kontrola fixace polohy rentgenovým snímkem, který se srovná s předchozími snímky z CT a MRI. Pak začne ozařování, které probíhá několik minut. V jeho průběhu detektory radioaktivity 20000krát za sekundu kontrolují intenzitu a další parametry svazku. Metoda velice pečlivé kontroly průběhu ozařování byla vypracována právě v ústavu GSI v Darmstadtu. Jak už bylo zmíněno, jedno ozařování nestačí a pacient chodí na jedno ozařování denně nejméně patnáct dní. Za několik týdnů potom se pomocí PET, CT a MRI zkontroluje, zda se podařilo nádor potlačit nebo dokonce úplně zmizel.

Při testech v GSI Darmstadt se ukázalo, že nejvhodnější je svazek uhlíku. Ten je dostatečně těžký na to, aby se při průchodu materiálem rozptyloval minimálně. Zároveň je jeho dolet v tkáni ještě dostatečně velký. Jádra s větším nábojem už ztrácí energii příliš rychle (ionizační ztráty rostou s kvadrátem náboje).

Do současnosti bylo na urychlovači v Darmstadtu ozařováno přes 300 pacientů. U těch, u kterých už uplynula pětiletá lhůta od léčení, umožňující říci, že nenastal návrat rakoviny, se ukazuje, že úspěšnost metody je okolo 75 až 90 procent (v závislosti na typu rakoviny). Je třeba ovšem poznamenat, že vysoká úspěšnost je ovlivněna i výběrem typu rakoviny. Tedy, jak už bylo zmíněno, dobře lokalizované nádory s relativně malým rizikem metastáz. Na základě velmi dobrých výsledků bylo ozařování ionty schváleno jako léčebná metoda. Toto léčení je už v Německu zařazeno mezi výkony hrazené zdravotní pojišťovnou. Náklady cyklu ozařování jsou zhruba 19 500 EUR, což je zhruba třikrát více než při použití klasických ozařovacích metod. Je to ale zhruba stejně jako intenzivní léčba s náročnou operací a následným pooperačním uzdravováním.
Nové ozařovací pracoviště v Heidelbergu
Na základě výsledku úspěšného testování metody v GSI Darmstadt se začalo budovat specializované pracoviště pro terapii pomocí těžkých iontů na Klinice University v Heidelbergu. Toto pracoviště se skládá z kruhového urychlovače (synchrotronu) těžkých iontů a tří ozařovacích míst. Urychlovač může poskytovat svazky protonů, helií, uhlíků a kyslíků. Ze tří ozařovacích míst jsou dvě určena pro horizontální ozařování. V nich je pacient upevněn na speciální plošinu a velice sofistikovaný automat zajistí jeho přesně definovanou fixovanou polohu při ozařování. Ještě před ozářením pohyblivý rentgen zajistí kontrolu polohy nádoru.
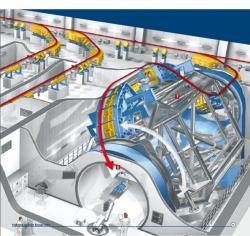
V třetím ozařovacím místě je umístěno světově unikátní zařízení – gantry, které svým otáčením okolo pacienta umožňuje měnit směr, ze kterého přichází svazek k pacientovi, a umožňuje ozařování ze všech směrů. Díky němu lze zajistit velice přesné zacílení různých míst nádoru a co nejkratší průchod paprsku zdravou tkání. Přesnost musí být lepší než půl milimetru.

Magnetické pole, které umožňuje zakřivovat dráhu velmi rychlých těžkých iontů musí být velmi intenzivní. Magnety gantry tak musí být velmi těžké. Celá konstrukce pak váží 600 tun. Místnost musí být klimatizována, aby změna teploty neměnila rozměry konstrukce.
Cena vynaložená na výstavbu celého zařízení bude 100 milionů EUR. Předpokládá se, že tam bude pracovat okolo sedmdesáti zaměstnanců a pracoviště by mělo ozařovat okolo 1300 pacientů ročně. Jak už jsem se zmínil, očekává se první pacient v tomto unikátním evropském zařízení už na podzim tohoto roku.
Jak dál v Evropě?
V současnosti se intenzivně studují nejlepší režimy práce při ozařování. Hledají se možnosti k tomu, aby se tato metoda dala využít pro co nejširší škálu nádorů. Velmi důležité je třeba hledání metod, jak se vypořádat s nádory v místech, kde není možná fixace polohy (například plicní nádory). Testují se postupy, které by dokázaly sledovat pohyb orgánů a měnit podle něho dráhu svazku.
Další možností je hledání částic, které by byly pro různé podmínky nejefektivnější. O testování možností využití antiprotonů, které na konci své dráhy anihilují a uvolní tak další porci energie, v evropské laboratoři CERN a účasti našich studentů na něm jsem se už na Oslovi zmiňoval.
Výstavba dalších podobných zařízení se v Evropě plánuje. Je jasné, že takovou nebo podobně finančně náročnou stavbu si nemůže dovolit každý stát a region. A nebylo by to ani účelné, protože takové zařízení může obsluhovat relativně rozsáhlou spádovou oblast. Právě v tomto směru je široký prostor pro účelnou integraci Evropy. Takovou, aby zajistila co nejvhodnější umístění takových zařízení. Aby byly co nejintenzivněji a nejefektivněji využívány a zároveň, aby měl každý občan naší Evropské unie v případě potřeby k takovému léčení přístup. K tomu je třeba zajistit potřebnou integraci a kompatibilitu zdravotního systémů, pojištění i zajišťování prostředků nejen na lékařský výzkum. Ale to už je úloha spíše pro politiky.
Stránky autora: http://hp.ujf.cas.cz/~wagner/
Diskuze:
Možná by to chtělo trochu znázornit
Pavel,2008-04-15 14:51:40
Pane Wagnere, pěkný článek, ale obávám se, že vaše povídání o ztrátách energie na dráze částic není pro každého stravitelné. Neměl byste pro názornost nějaké staré snímky z bublinových komor, kde to je tak hezky vidět? Elektron - téměř spojitá čára, na konci dráhy nepatrně zesílená, proton - občas bublinka a na konci dráhy velký flek.
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce