Tajemství vody - vodíkové můstky
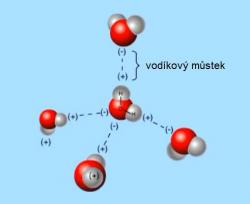
Voda, životodárná substance, kterou již starověcí filozofové, například v 5. století p. n. l. Empedoklés ze Sicílie, považovali za jednu ze základních látek tvořících svět. Dodnes fascinuje. Jak vědce, tak mystiky a esoteriky. A není to jenom kvůli její nezbytnosti k životu a základnímu podílu na složení živých organismů. Neutuchající zájem vzbuzují její vlastnosti vyplývající z jednoduché stavby molekuly, tvořené jedním atomem kyslíku a dvěma vodíky. Tato trojice se naštěstí neváže symetricky v linii, ale tvoří otevřené véčko s úhlem 104,5 stupňů. Kyslík, ve snaze doplnit svoji valenční vrstvu 2p do stabilního oktetu, se v molekule H2O stává spoluvlastníkem jediného valenčního elektronu každého z obou vodíků. Tím se naruší prostorová elektrická neutralita všech členů tohoto triumvirátu, na straně vodíků převládne kladný náboj jejich jader, u kyslíku pak záporný náboj sdílených elektronů. Molekuly vody jsou proto polární a elektrostatické síly je nutí se k sobě natáčet opačnými náboji a uzavírat ne příliš silné spojenectví zvané vodíkové můstky. Jsou to vskutku jakási přemostění mezi kyslíky různých molekul pomocí vodíků. Tepelný pohyb molekul ale způsobuje, že tyto slabé mezimolekulární vazby jsou nestabilní, v okamžiku vznikají a pak zanikají v celém objemu kapaliny. Přece jenom ale zajišťují jistou soudržnost mezi molekulami, díky čemuž má voda nejen poměrně velké povrchové napětí, což využívají některé druhy hmyzu, třeba bruslařky, ale i mnohem vyšší teplotu varu, než by jí podle velikosti a hmotnosti molekuly přináleželo.
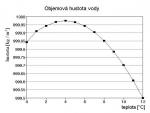
Hustota vody souvisí s tepelným kmitáním molekul. Při vyšší teplotě jim kinetická energie umožňuje intenzivnější chaotický pohyb (v pikosekundovém časovém měřítku), při němž překonávají energeticky nejvhodnější vzdálenosti doporučené rozložením elektrostatických sil jejich polárních částí. V kapalné vodě tak dochází k bližším kontaktům, než odpovídá konstelaci s nejnižší potenciální energií systému. Z hlediska statistiky jsou nejmenší mezimolekulární vzdálenosti při teplotě 4 °C, kdy má voda nejvyšší objemovou hustotu. Když při teplotě 0 °C, za normálního tlaku 1 atmosféry (101,325 kPa = 760 Torrů) průměrná energie molekul klesne na úroveň energie vodíkové vazby, začnou být vodíkové můstky stabilnější, tepelný pohyb je ohrožuje méně. Tvoří se krystalizační jádra – shluky do pravidelné struktury se spojujících molekul, kde je každá přes vodíkové můstky připoutána ke čtyřem dalším. Krystalizační jádra vznikají zejména na kontaktu s povrchem cizorodé pevné látky, což mohou být mikroskopická zrníčka různých nečistot. Tyto zárodky pak postupně rostou do celého objemu kapaliny - vzniká led. Symetrie jeho vnitřní struktury ho řadí do šesterečné (hexagonální) krystalografické soustavy. Protože je v ledu podstatná většina molekul uvězněna vodíkovými můstky do energeticky sice nejvýhodnější, ale prostorově dosti rozvolněné formace, má menší objemovou hustotu než kapalné skupenství. Na hladině proto plave a neklesá ke dnu, i když je chladnější než tekutá voda pod ním. Snad není nutno opakovat, jak je to pro pozemský život důležité. Voda je jedním z hlavních činitelů, který formuje celý povrch naší modré planety.
Voda, která odolává teplu i mrazu
Ne vždy se ale vše děje podle těchto poznatků, které se nám snažili nalít do hlavy ve věku školou povinném. S rostoucím tlakem se za nízké teploty či spíše mrazu struktura ledu mění a různých, povětšinou metastabilních strukturních forem vody známe již 16 (Wikipedie uvádí 15, zdroje z roku 2003 jenom třináct, z čehož je vidět, jak rychle v laboratořích objevují další). Teď ale zaostřeme optiku na zvláštní stav kapalné vody. Meteorologové i piloti letadel dobře znají typ střední až vyšší oblačnosti (altocumulus), která často bývá tvořena ne ledovými krystalky, nýbrž kapičkami vody podchlazenými až na neuvěřitelných -40 °C. Ty na styku s povrchem pevných těles okamžitě vytvářejí ledový krunýř a mohou letadlům způsobit vážné problémy. Proto se hledají způsoby, jak tomuto nebezpečí předejít nejen změnou trasy letu, ale i různými úpravami povrchu a ohřevem nejohroženějších částí.
Čím je čistá voda, která se při proměně v led musí spoléhat jenom na vazby mezi vlastními molekulami podchladěnější, tím je samozřejmě k změně skupenství náchylnější. Souvisí to s rychlostí tvorby krystalizačních jader a jejich velikostí. Aby byly tyto zárodky stabilní a dále se rozrůstaly, musí se přes vodíkové můstky najednou pospojovat do trojrozměrného ledového krystalku dostatečný počet molekul. A těch není málo. Za normálního tlaku ještě při teplotě -5 °C je to okolo 50 000 molekul H2O, při -20 °C jich stále musí být několik stovek a až při -40 stupních stačí na stabilní krystalizační jádro kolem 70 molekul. Při stejnoměrném ochlazování za specifických podmínek může velmi čistá voda až do teploty -41 stupňů zůstat tekutinou. Do tohoto teplotního limitu v ní může docházet k tvorbě příliš malých a nestabilních jader homogenně roztroušených v celém objemu, přičemž rychlost s jakou vznikají stíhá vykompenzovat nový rovnovážný stav mezi kapalnou a tuhou fází.
"Klasický“ led krystalizující v šesterečné soustavě je za běžných podmínek tou nejstabilnější formou vody, jež se nemění v rozsahu dvě stě stupňů, od 72 po 273 Kelvinů - tedy od -201 °C po nulu. Když ale nezohledníme míru stability a vezmeme v úvahu i metastabilní formy přehřáté a podchlazené kapalné vody, pak ta může led co do teplotního rozsahu překonat. Lze ji totiž za běžného tlaku udržet tekutou až v rozsahu přes 300 stupňů. Samozřejmě v laboratorních podmínkách, kde je možné velmi čistou vodu přehřát až na 280 °C, nebo podchladit na zmíněných -42 °C. Při těchto limitních teplotách pak dochází k narušení velmi vratké rovnováhy.
Do jisté míry si oba případy můžeme odzkoušet i v domácích podmínkách. Přehřátí vody nad sto stupňů a takzvaný skrytý var se nám často i nechtěně podaří v mikrovlnné troubě, když dáme do ní vařit čistou vodu v dostatečně čisté skleněné nádobě. Nejdřív jakoby nechtěla vůbec začít vřít. Ale když pak do ní nasypeme pár zrníček například mleté kávy, předtím zdánlivě klidná voda vybuchne v prudkém varu... a vykypí.
Také podchlazení čisté vody se nám může podařit, když ji v uzavřené plastové láhvi vložíme na nějakou tu hodinu do mrazničky a včas vytáhneme. Pak můžeme sledovat, jak se při otřesu, lití nebo vložení kovového předmětu rychle mění v led. Následující video nabízí úryvek z dokumentárního filmu o vyšetřování havárie letadla Airbus A330-200 společnosti Air France, které se při letu Flight 447 1. června 2009 zřítilo do vod Atlantiku. Zahynulo 216 pasažérů a 12 členů posádky (Wikipedia). Jednou z příčin havárie mohla být právě námraza.
Ještě pro zajímavost vzpomeňme amorfní formu ledu, takzvaný skleněný led. Vzniká, když se voda ochlazuje velmi prudce, rychlostí až milion Kelvinů za sekundu, a uspořádaná vnitřní krystalová struktura se nestihne vytvořit. Nebo když na krystalický led působí za nízké teploty velký tlak. Skleněný led s neuspořádanou molekulární strukturou je pravděpodobně tou nejčastější formou vody ve vesmírných chladných prachoplynových oblacích a v kometách.
"Přechodný" led
Co ale určuje tu nejnižší teplotu, na kterou může být chemicky čistá voda ochlazena a pod ní se pak již nezadržitelně mění v led? Tuto otázku si položily dvě chemičky z americké University of Utah v Salt Lake City, Emily Mooreová a Valerie Molinerová, autorky článku zveřejněném v nejnovějším vydání časopisu Nature. Tvrdí, že doposud nebyl dostatečně prozkoumán mechanismus vzniku ledu při teplotě nižší než je spodní teplota homogenní tvorby krystalizačních jader -41 °C a předpokládají, že musí existovat souvislost mezi termodynamickými anomáliemi a rychlostí krystalizace ledu. Výsledky jejich studie prokázaly, že míra krystalizace vody dosahuje maximum okolo 225 K, tedy při -48 °C. Při této teplotě již celý objem vody nezadržitelně promrzá, a v podstatě všechny molekuly uvězní vnitřní struktura ledu.
Aby Moreová s Molineovou mohly blíže prozkoumat a popsat celý proces neodvratné změny skupenství podchlazené dokonale čisté vody při této limitní teplotě, vytvořily simulaci pomocí počítačového modelu. Jeho výhoda spočívala v chytrém zjednodušení vzhledem k předchozím podobným pracím.
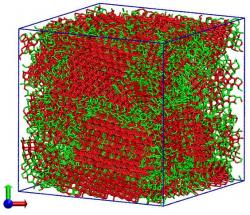
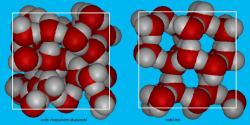
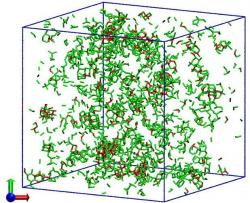
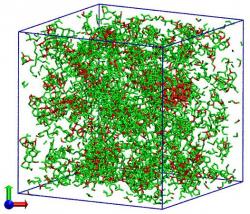
Chemičky tříatomové molekuly nahradily fiktivními vnitřně nediferencovanými částicemi, které v počítači nechaly se navzájem spojovat podle pravidel vodě vlastních. Zjednodušení, díky němuž nároky na výpočtovou techniku, zejména strojový čas, klesly na 1 % klasických atomárních modelů, autorkám umožnilo v reálném čase pracovat s 32 768 takovými částicemi. Jejich program vyhodnocuje změny tepelné kapacity, hustoty a stlačitelnosti podchlazené vody a simuluje jak rychle a jakým způsobem probíhá krystalizace ledu ve skupině tvořené 4 000 molekulami. Tak se jim podařilo ukázat, že změna skupenství, kdy se kapalná voda v celém svém objemu proměňuje v krystal, se děje přes mezistupeň – jakýsi „přechodný" led s jenom částečným vnitřním uspořádáním. Představme si základní buňku ledové krystalové struktury jako pravidelný čtyřstěn, v centru kterého je molekula vodíkovými můstky napojena na čtyři další ve vrcholech. Pak v "přechodném" ledu se tyto buňky orientují a spojují tak, že spolu nevytvářejí kompaktní pravidelnou strukturu, jako je tomu u běžného šesterečného ledu. Zajímavostí je, že i u amorfního skleněného ledu, jenž vzniká při velmi prudkém ochlazení kapalné vody, část jeho molekul ztuhne ve formaci "přechodného" ledu. Nejlépe tento mezistupeň dokumentuje trojice obrázků po obou stranách tohoto textu.
Autorky jsou přesvědčeny, že výsledky, které zpřesňují poznatky o procesu zamrzání podchlazené vody, pomohou klimatologům při modelování vzniku oblačnosti a jejího vlivu na klima.
Vědci stvořili superionizovaný led. Je žhavý skoro jako Slunce
Autor: Stanislav Mihulka (10.05.2018)
Pozemská voda je starší než Slunce
Autor: Stanislav Mihulka (30.09.2014)
O tajemstvích vody a (ne)dokonalostech rampouchů
Autor: Dagmar Gregorová (05.01.2011)
Diskuze: