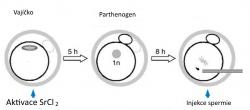
Poté co zralé vajíčko ovuluje do vejcovodu, je v jeho horní třetině oplozeno spermií. Jakmile spermie penetruje do vajíčka, jeho cytoplazma je tak mocná, že se spermie začne velmi rychle a razantně měnit – tvoří tzv. prvojádro a stává se nedílnou součásti embrya. Nicméně pokud spermie doputuje příliš pozdě, nemá vajíčko ani spermie na zdárné splynutí dobré vyhlídky. Vajíčko totiž prodělává změny, souhrnně označující se jako stárnutí (ano, i vajíčko může zestárnout). Jedním z projevů stárnutí je totiž i partenogenetická aktivace, kdy se vajíčko začne samo dělit a dá vzniknout „jedinci“, jehož další existence není slučitelná ani s implantací v děloze, ani s pozdějším embryonálním vývojem. Vajíčka, která nepodlehnou partenogenetickému vývoji, jsou předurčena k buněčné smrti a zániku, ale i partenogenetická embrya nakonec zemřou. K stárnutí oocytu, včetně partenogenetické aktivace, dochází běžně, aniž by si to měsíc co měsíc ovulující žena připouštěla.
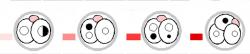
Ve světle tohoto poznání by nás ani ve snu nenapadlo, že by vajíčko mohlo být spermií penetrováno a oplozeno, pokud přijde „s křížkem po funuse“, tedy ve chvíli, kdy vajíčko stárne a je např. partenogeneticky aktivované. Takový partenot totiž postrádá genetickou informaci od obou rodičů, ale chvilku trvá, než mu to začne vadit. Studie vědců z Velké Británie a Německa však uznávané dogma zrušily. Přináší důkaz, že to jde – v jejich podání experimentálně.
Vědci v čele s Toru Suzuki pracovali s myšmi; u těch je dobře zvládnutá reprodukce v podmínkách in vitro a výhodou také je, že mají velmi krátký generační interval. Už samotné tyto dvě vlastnosti si říkají o nejrůznější kejkle. Koneckonců, těch největších jsme se nejdříve a nejčastěji dočkali právě na myších – od běžného in vitro oplození, intracytoplazmatické injekce spermií až po klonování nebo dnes již rutinně používané genetické modifikace. Toru Suzuki s kolegy ale pustil svou fantazii ještě o kus dál: uměle vyvolali partenogenetickou aktivaci vajíčka v podmínkách in vitro a do vzniklé zygoty potom vpravili spermii. Ti střízlivější z nás by čekali, že takové embryo nemá šanci na zdárný vývoj a partenota těžko přemluvíme k tomu, aby se vyvíjel jako plnohodnotné embryo.
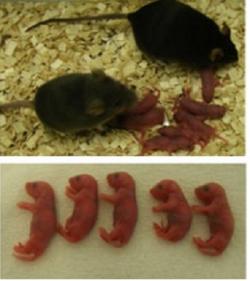
Jenže co se nestalo, spermie vpravená do embrya se vší silou zapojila do již běžícího embryonálního vývoje. Výsledkem bylo embryo, které se po embryotransferu mělo velmi čile k dalšímu vývoji. Důkazem jsou myšata, která se z těchto embryí narodila! Práce tak ukazuje na mocnou sílu časného embrya, kdy je ještě stále schopno přeorganizovat spermii k obrazu svému. Není to tedy exkluzívní výhrada jen vajíčka, ale také zygoty a blastomer časného embrya.
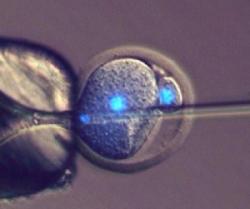
Ještě „čerstvá“ studie přináší bezpochyby revoluční poznání. Lze ale nyní předpokládat, že některé děti vznikají ze stárnoucích oocytů a jejich „první život“ byl partenogenetický? Anebo že by to byly spermie a nikoliv vajíčko, kdo tu vládne takovou mocí a dokáže zvrátit dosavadní vývoj embrya? Zatím je potřeba nahlížet na několik artefaktů, se kterými Toru Suzuki a spol. v laboratoři pracovali: samotné in vitro oplození je tomu běžnému - fyziologickému oplození ve vejcovodu „na hony“ vzdálené a postrádající řadu přirozených bariér. A Toru Suzuki navíc použil ještě silnější kalibr – intracytoplazmatickou injekci spermií, kterou „prolomil“ přirozený polyspermní blok aktivovaného vajíčka. Nehledě na míru partenogenetické aktivace – ta je po její umělé stimulaci téměř stoprocentní, zatímco v in vivo podmínkách je to otázka náhody, notabene když u člověka ovuluje jediné vajíčko!
Když už jsme odstavili na druhou kolej možnosti, že by k něčemu podobnému mohlo dojít v těle budoucí matky, nabízí se otázka, jak lze nejnovějších poznatků využít. Tím skutečným potenciálem jsou totiž lidské embryonální kmenové buňky, na které tímto dostáváme nový pohled: partenogenetická embrya jsou totiž z etického hlediska o něco schůdnějším zdrojem embryonálních kmenových buněk. Zatím postrádala svojí atraktivitu, protože se jednalo o právě nepoužitelné partenoty. Nyní se pohled na ně může razantně změnit. Nepoužitelná už rozhodně nejsou.
Literatura
Toru Suzuki, Maki Asami, Martin Hoffmann, Xin Lu, Miodrag Guzˇvic´, Christoph A. Klein, Anthony C.F. Perry.: „Mice produced by mitotic reprogramming of sperm injected into haploid parthenogenotes“. Nature Communications, 7, 2016. doi:10.1038/ncomms12676
Diskuze:




