Amoniak je dnes jednou z nejvíce průmyslově vyráběných chemických látek. Pro moderní společnost je nepostradatelný. Nejvíce amoniaku spotřebuje výroba hnojiv, ale používá se i při produkci plastů, vláken, výbušnin, léčiv a v řadě dalších odvětví. Každoročně se ve světě vyrobí asi 230 milionů tun amoniaku.
Prakticky veškerý amoniak (NH3) se dnes vyrábí klasickou Haberovou-Boschovou syntézou. Jde o přeměnu atmosférického dusíku na amoniak reakcí s vodíkem, za vysoké teploty a tlaku, a za přítomnosti kovového katalyzátoru. Proces postupně vyvinuli na počátku 20. století němečtí chemici Fritz Haber a Carl Bosch. Tehdy to byl velmi významný objev, který změnil zemědělství i vojenskou výrobu. Právě tento proces bývá považován za „detonátor lidské populace“, protože vedl k explozi počtu lidí na Zemi.
Dnes je Haberova-Boschova syntéza vnímaná jako extrémně velká zátěž pro životní prostředí. Používaný vodík se získává z metanu, přičemž se na každých 1,1 tuny vodíku uvolní do atmosféry 6 tun oxidu uhličitého. Výsledkem je, že výroba amoniaku spotřebuje 3-5% světové produkce zemního plynu a vytvoří asi 1,8% emisí oxidu uhličitého. Zároveň se do atmosféry dostane množství nebezpečných oxidů dusíku. Celkově vzato, svět by si oddechl, kdyby se povedlo nahradit Haberovou-Boschovou syntézu moderním procesem, který by tolik nezatěžoval planetu.
Takový průlomem je možná nadosah. Jsou o tom přesvědčeni badatelé australské Monash University, kteří hlásí průlom v „zelené“ výrobě amoniaku. Bryan Suryanto a jeho kolegové odstranili z rovnice výroby amoniaku zemní plyn a produkují amoniak při pokojové teplotě s vysokou výtěžností.
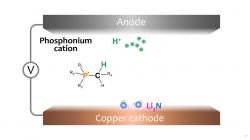
Jejich nový proces je podobný elektrolýze vody při výrobě vodíku. Rozdíl je v tom, že proces využívá elektrolyty známé ze světa lithiových baterií. Výroba zahrnuje elektrolytické články, v nichž je obsažený rozpuštěný dusík. Když takovým článkem prochází proud, tak na povrchu měděné katody vzniká nitrid lithia Li3N. Elektrolyt článků obsahuje fosfoniové soli, které fungují jako účinný nosič vodíkových iontů, tedy protonů. Když vodíkové ionty dorazí ke katodě, tak nahradí všechny tři atomy lithia a z nitridu vznikne amoniak. Ten se uvolňuje z povrchu katody a může být dál využit. Fosfoniové soli se neustále recyklují a proces může nepřetržitě běžet až 4 dny.
Nový proces je tak „zelený“, jak „zelená“ je použitá elektřina. Podle svých tvůrců může běžet jak v extrémně malých zařízeních, jako jsou například skleníky, tak i v rozsáhlých průmyslových provozech. Badatelé si již tento postup patentovali a založili spin-off Jupiter Ionics, který by měl tuto technologii dostat na trh. Uvidíme, zda se jim konečně podaří „zabít“ hydru Haberovy-Boschovy syntézy.
Video: New Research from the Monash Ammonia Project
Literatura
Nanotrubičky novým zázračným hnojivem?
Autor: Stanislav Mihulka (28.10.2009)
Litr paliva za 20 centů
Autor: Josef Pazdera (12.09.2011)
Britští Reaction Engines vyvíjejí amoniakové reaktory pro letadla
Autor: Stanislav Mihulka (14.11.2021)
Diskuze:
Kolem kolika os začíná Fritz rotovat? Pilný nobelista je stále chladný.
Josef Hrncirik,2021-12-07 22:03:39
Reakce je přiměřeně exotermická a umožňuje snadný ohřev směsi na potřebnou teplotu, a malý přebytek tepla lze využít k pohonu kompresorů, aniž by byl příliš velký a bylo nutno ho převádět do výroby elektřiny. Pokud zlé jazyky tvrdí, že z výroby 1,1 t H z CH4 odpadá 6 t CO2, tak tím jen popisují stechiometrii, že 1 molekula CH4 se dá relativně snadno převést reakcí s vodní parou na 4 H2 a 1 CO2. Spotřeba energie není tak velká, aby bylo nutno pálit další významné množství plynu, ev. se dá pokrýt přebytky energie z H.-B. procesu. Je to vlastně pochvala, že reformace CH4 a HB syntéza jsou dobře sehraní dvojka rovnovážné mírně endotermické reformace a rovnovážného mírně exotermického HB.
Ekologa by mělo především zajímat, že během století klesla spotřeba energie u HB z původních cca 100 na 26 MJ/kg NH3. I když není energie jako energie, zde dává dobrý smysl, že jde asi o teplo z výhřevnosti spotřebovaného CH4. Někteří ekologové si dokáží spočítat, že na 17 g NH3 to je 442 kJ a na 1 mol H v něm 1/3 tj. 147 kJ které potřebujeme k uložení energie ve formě 1 g H2 v NH3. K uvolnění H2 z kapalného NH3 v nádržce je zapotřebí dodat výparné teplo NH3 a rozbít slabé vazby N-H. Zatímco výhřevnost volného H2 je 141 kJ/g, vodík z kapalného NH3 v na držce dá jen 97. Vraž do toho 147 kJ a možná se Ti vrátí do dížky až 97 kJ. Účinnost tohoto výhřevnostního tripu je satanistických 666°/°°
Zelení Mužíci (? Z Krymu) se ke svému tripu vynořují z vody a tvrdí že ji na svých atomových poddnorkách elektrolyzují s účinností 70%. Rozkladné napětí vody je 1,23 V minimálně. Z vody tedy vyhání H2 napětím 1,76 V. Na 1 g H pak vyplýtvají cca 170 kJ což je 141/170=83% výhřevnostní účinnosti.. Jak vidno, pro šmejdy je dost prostoru i na poddnorkách. Využívají ponorkového effektu k nadsazení účinností záměnou za ůčinnosti a tvrdí že vysokoteplotní elektrolýzou 83% brzy po vynoření dosáhnou. Z ekonomických důvodů se elektrolyzuje spíše při max. kapacitě než účinnosti a tak na uvolnění vodíku je spíše než 1,76 V zapotřebí 2,09V. Aby se v tom prase vyznalo! Potom máme ů činnost 59%. Šmejdi to snadno vysvětlí transformátory, usměrňovači, chlazením elektrolyzérů, odpory vedení, čistěním a kompresí H2 i O2. Nerýpejme do nebezpečných šmejdů, pracujících elektrolyzérů a prohlašme nahlas, že na vyhnání energetických výhřevnostních žížal H2 z vody stačí 1,76 V. Nyní vidíme jasně, že Fritz tlačil žížaly energie tvářící se formálně jako H2 získaný silou
147 kJ / 96 500(A.s) tj. 1,52 V do NH3 a výhřevnost však poskytující jen 666°/°° tj. 1,01 V . Hnědý Fritz tedy nabíjí v lampárně baterii (azan) formálními 1,52 V a ajzenboňákům z toho krásně svítí až 1,01 V.
U hnědého Fritze rozdíl 1,52 V - 1,23 V = 0,29 V představuje energii pro reformaci, a ztráty z nevratností. Jestliže trip výhřevností:
Energie - NH3 - energie má účinnost 67%, účinnost HB je cca odmocnina = 0,81
Zelený Fritz k získání zeleného H2 prý potřebuje jen 1,76 V, ale vmontování do NH3 má účinnost řekněme 0,81, tj. formálně nabíjecí napětí v lampárně stoupne na 2,17 V ale furt to svítí jen 1,01V. Účinnost zeleného HB tripu je tedy jen 46%.
Khaki zelení pětiocí spojenci, protinožci z Klokánie navrhují jako průlom (asi špatně přeložený průser) místo krásného 3H2 + N2 = 2 NH3
Vtipný Trip : 6 Li+ + 6 e- + N2 + 3 H2 - 6 e- = 6 Li + N2 + 3 H2 – 6 e- = = 2 NLi3 + 6 H+ = 2 NH3 + 6 Li+
N2 reaguje teprve s Li za vzniku nerozpustného nitridu na povrchu Li. Povrch se obnovuje redukcí Li+ z disociovaného LiBF4 rozpuštěného v elektrolytu, a rozpouštěním nitridu vhodným fosfoniovým kationtem uvolňujícím potřebné H+ přechodem do nenabité ylidové formy. H+ ionty se obnovují redukcí plynného H2 na anodě, který však musel být vyroben elektrolýzou vody v jiném elektrolyzeru, nikoliv zadarmo. Zde by nutně uvolněný kyslík zlikvidoval fosfonium a organické látky, vysrážel Li+ atd. . Při nesmírně pečlivém a nákladném čištění N2 i H2 k tomu dojde pouze o něco později. Systém prostě není Idiotenfest. I při neprakticky nízké proudové hustotě 30 mA/cm2 bylo k elektrolýze nutno použít napětí 5 V, aby H2 přecházel do roztoku jako H+ a navíc se vyredukovalo Li. Systém měl proudovou ůšinnost jen cca 70%, 30% proudu nejspíš něco hlodalo v elektrolytu. Odolnější chemikalie či menší proudová hustota by mohly zvýšit nábojovou účinnost až ke 100%, nutnost použít H2 vyrobený napětím cca 1,7 V jinde a znovu ho rozpouštět napětím určitě min. 4 V až k vyloučení Li zůstává. Navržené zařízení nakonec aplikuje na vodík napětí cca 1V navíc k 1,75 V z jeho výroby kdesi a 4 V pro vyredukování Li tj. v souhrnu se aplikuje napětí (4 +1,75)/0,7= 5,75/0,7 (účinnosti) = 8,2 V. Momentální khaki zelený NH3 je 8,2V/1,52 V = 5,4 horší než černý HB a 8,2/2,09 = 3,9x než zelený HB. Vždy bude více než (3+1,75)/2,09 = 2,27x horší než zelený HB. Znovu připomínám, že khaki HB neměl vyřešeno čistění N2, dlouhodobou stabilitu a systém čištění a kapalnění NH3 ze směsi s N2, H2 a parami rozpouštědla.
Tuda nět!, mnogo let tomu nazad skazal komandir Soso Džugašvili.
Peer to peer reviewers v Science to však nevidí. To je poněkud ball breaking chucpe.
Scientists at Australia's Monash University claim to have made a critical breakthrough in green ammonia production that could displace the extremely dirty Haber-Bosch process, with the potential to eliminate nearly two percent of global greenhouse emissions.
The advantage of this new process is, says collaborant Dr. Alexandr Simonov that it's a single step, not requiring a hydrogen electrolysis
Re: Kolem kolika os začíná Fritz rotovat? Pilný nobelista je stále chladný.
Vladimír Bzdušek,2021-12-08 18:37:43
Haber demonštroval proces r. 1909, Bosch priemyselne realizoval r.1913, Nobelova cena r. 1918. Vzhľadom na nadšený tón článku o novom postupe by som očakával podobné tempo?
Re: Publish it and very quickly perish!
Josef Hrncirik,2021-12-09 11:45:19
Additional benefits in that it would eliminate the distribution and transport that contribute significantly to the financial and emissions costs of the current ammonia model.
The advantage of this new process is that it's a single step, not requiring a hydrogen electrolysis process earlier in the chain. Presumably this will make it more energy-efficient, yielding more ammonia per unit of renewable energy. (tomu uvěří pouze ylidy omámení trhovci)
The team has patented the technology and spun off a business, Jupiter Ionics, to commercialize it, drawing in a seed round of US$1.8 million to get things started.
Peer to Peer reviewers honestly (Peer to Peer) to Chief Editor: "This paper will be ball breaking bursa bombing! You must publish it!! and very quickly perish!!!
Trochu jsme si zaspekulovali na burze s Li, Pt , kostíkem a dusíkem.
Nákupčí důchodových fondů to od Nás vše rádi koupí za Pt.
Za co by jinak utráceli čerstvě natištěné doláče.
Pochopitelně, že proti zelenému HB s elektrolytickým H2 je to energetický nesmysl. Elektrolytický vodík potřebujeme ve stejném množství a navíc při převodu na H+ v špatně solvatujícím prostředí do něj musíme vrazit zbytečně další 1 V. K vyredukování Li z Li+ potřebujeme kdykoliv nejméně 3 V a pro překonání přepětí a odporů další 1 V. To máme bratru 5 V pro uložení H touto podivnou, řekněme řekněme khaki cestou útoku na start up a burzu. Oproti svěže zelenému HB s tímž elektrolytickým H2 kde to protlačíme jen 2,09 V, khaki akce svými 5 V je 2,4x nesmyslnější. Ztracené teplo vzhledem k nízké teplotě a velké nevratnosti nejsme schopni nijak využít, avšak musíme ho pracně odvádět (? Do teplých skleníků s pšenicí či bavlnou s nimi!).
Na 3. oslovském obrázku starťáci tají přívod H2 k anodě. Ukazují pouze z něj vzniklé H+. Mají pravdu, trhovcům zmateným ylidy H2 nechybí, naopak jsou rádi, že ho grafik zázračně ušetřil či pod rukou prodal. Ani jim nevadí, že černokněžník tvrdí, že proces může nepřetržitě běžet až 4 dny. Hlavně že jsme investovali Své doláče do Start Up.
„Zabít“ hydru extrémně špinavého Fritze ("father of chemical warfare") se jim určitě nepodaří!
Naopak budou do Edenu vychvalovat jeho maximální energetickou úspornost plynoucí z mnohem lepší vratnosti kroků i jeho nekompromisní vývoj aplikace BCHL.
BURSA BOMBING!
ALLAHU AKBAR!! "
Re: Odkiaľ je ten dusík?
Tomáš Pilař,2021-12-06 18:52:50
Dusík je ze vzduchu, tam je ho docela dost.
Re: Re: Odkiaľ je ten dusík?
Vladimír Bzdušek,2021-12-06 19:17:13
OK, ale nevadí potom prítomnosť kyslíku vo vzduchu, jednak lítiu a druhak elektrolytu?
Resp. privádza sa tam vzduch alebo čistý dusík?
Re: Re: Re: Odkiaľ je ten dusík?
Tomáš Pilař,2021-12-07 08:35:06
Pro HBS se používá čistý dusík, ono by to ani jinak nejde. Protože aby šlo "ukecat dusík, aby se dal dohromady s vodíkem", tak se vodík opravdu nesmí "rozptylovat", byť jenom malým pomyšlením na reaktivnější atomy. Pro novou technologii to musí platit taky, reakční poměry ("ochota ke spolupráci") jsou stejné
fosfoniové soli ?
Florian Stanislav,2021-12-03 21:01:34
Článek o dosavadní výrobě :"Používaný vodík se získává z metanu, přičemž se na každých 1,1 tuny vodíku uvolní do atmosféry 6 tun oxidu uhličitého. "
https://oenergetice.cz/slug/krakovani-metanu-aneb-jak-vyrabet-vodik-bez-emisi-co2
Rok 2015, výzkum.
" V procesu zvaném „krakování metanu“ se od sebe při teplotě přes 750 °C oddělí dvě hlavní složky metanu, uhlík a vodík, bez emisí skleníkových plynů..Energetická účinnost celého procesu je lehce vyšší než u parního reformování a o 20 % vyšší než u zplyňování uhlí. Pokud jde o emise CO2, tak jejich celková produkce z tohoto procesu je srovnatelná s elektrolytickým způsobem výroby vodíku a o více než 50 % úspornější oproti výrobě H2 parním reformováním."
Fosfoniové soli (zdroj uvádí fosfoniové kationty)
R1 H
I I
[ R2- P +] - C- R4
I I
R3 H
jsou zřejmě silně toxické, schopné uvolnit fosfan. Vzpomínám si na lehčí nevolnost při celodenním dělání malty z čerstvého karbidového vápna, kde je cítit česnekově fosfan. Toxicita fosfoniových solí může být potíž v malém provedení (výroba amoniaku jako hnojiva pro skleníky?).
https://www.siad.com/cs/bezpecnost/bezpecnostni-list-materialu?p_p_id=com_liferay_sheet_portlet_SecuritySheetPortlet_INSTANCE_T7lbJDQJQNxs&p_p_lifecycle=2&p_p_state=normal&p_p_mode=view&p_p_cacheability=cacheLevelPage&p_p_col_id=column-3&p_p_col_count=2&_com_liferay_sheet_portlet_SecuritySheetPortlet_INSTANCE_T7lbJDQJQNxs_filename=00100_LIQ_CZ.pdf
Expozice povolené pro fosfan jsou desetiny mg/m3
Zdroj Science uvádí :" tetraalkylfosfoniové soli místo ethanolu (viz Perspective od Westhead et al. ). Tento kationt může stabilně podstupovat cykly deprotonace-reprotonace a jako další výhoda zvyšuje iontovou vodivost média"
Re: fosfoniové soli ?
Florian Stanislav,2021-12-03 21:06:07
alkylsufoniové soli v schématu odkazu
[R1,R2,R3) P+] - C(H, H, R4).
zelený vodík
Tomáš Pilař,2021-12-03 15:56:30
I stávající syntéza (Haber-Boschova) je přesně tak zelená, jak zelený je používaný vodík. Pokud do pro ní použijeme "zelený vodík", tak dostaneme "zelený amoniak". Akorát že zelený vodík je příšerně drahý, tak bychom dostali příšerně drahá hnojiva (bavíme se spíš o řádových rozdílech). Jak je HBS vysokoteplotní a vysokotlaká, tak výrobní zařízení musí být "velký krám".
Teoretický půvab nové technologie může spočívat v tom, že zařízení může být malé. Zároveň ale narazí na to, že syntéza amoniaku je exotermická, takže pokud do něj nějakou energii budu cpát (čistý vodík místo methanu, elektřina na elektrolýzu), tak bude potřeba ještě o trochu víc chladit.
V současném světě zatím vypadá jako cesta k řádově dražším hnojivům (10x), teda nic moc.
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce