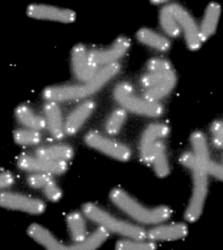
Telomery
Ne vždy, to co je na konci, je také bezvýznamné. Platí to i pro konce chromozomů, které jsou tvořeny krátkými, opakujícími se sekvencemi nukleotidů. Tyto motivy, kterých jsou až dva tisíce, na sebe nalepí specifické proteiny a stanou se z nich komplexy odolávající destrukčním enzymům. Jsou to klíčové struktury, které nejen chrání DNA před poškozením, ale jak se ukazuje, mají toho na starosti mnohem více.
Dělení
Buňky se občas dělí, jinak bychom nemohli existovat. Při jejich množení je potřeba zajistit, aby se zkopírovaly i data uložená ve formě dvojšroubovice. Děje se to replikací za asistence enzymu polymerázy. Nezbytný je k tomu malý spouštěcí kousek vlákna, nazývaný primer. Po zdvojení DNA se primery samy odstraní a buňka je zlikviduje. Tak se to opakuje, přičemž každé nově vytvořené dceřiné vlákno je o kousek odpovídající primeru kratší. Každým dělením buňka přichází na koncích chromozomů o 50 – 200 párů bází. Systém prostě není dokonalý a enzym tvořící věrnou kopii DNA nedokáže syntetizovat konce lineárních nukleových kyselin. Všechno zlé je k něčemu dobré a organismy toho využily ke zhotovení stroje času. Délkou telomer si buňky sledují svůj věk. Nikoli stáří fyzické, nýbrž replikativní. Jde v podstatě o účetní evidenci, kolikrát buňka podlehla nutkání se pomnožit. Jednoduchým mechanismem nás chrání před poblázněnými buňkami, které se vymkly kontrole a začnají růst v nádor. Zastaví je otřepaná telomera. Krátké ošoupané konce chromozomů připomenou buňkám jejich věk a po několika děleních jim naroste počet zlomů DNA a buňka si připraví zdárný konec. Učeně se tomu říká apoptóza.
Je pravdou, že více zlomů a poruch v DNA se tvoří na sklonku života buněk, ale dost mutací vzniká i za dob jejich kariérního růstu. Pošramocený operační program mladých buněk jsou vždy hrátky s čertem a těm je potřeba se co nejdříve postavit čelem. Buňka čelo nemá a tak se tváří v tvář rostoucí hrozbě rozlámané DNA staví aktivací genu p53. Jde o jakýsi „alarm program“, který vypne normální buňce růst, zastaví jí choutky na dělení a naordinuje jí klid na lůžku, dokud se poškození neopraví. Pokud se to nepodaří, spouští se program cíleného sebezničení.
Posouvání biologických hodin zpět
Od některých buněk chceme, aby se dělily vícekrát než ty ostatní. Třeba u bílých krvinek si na nějaké pravidlo typu „třikrát a dost“ hrát nelze. V případě infekce je potřeba co nejrychleji rodit regimenty nových vyškolených zabijáků schopných zachránit situaci a ničit agresora. Podobný pardon je třeba udělit i v případě odřené kůže, tam také nelze nechat ránu dlouho „bez obvazu“. U střeva plného patogenů, kterým se nechce zůstat jen tam, kde jsme jim to vymezili, nějaká přísnost také není na místě. Zmíněným buňkám je třeba dát jistou míru volnosti, aby se mohly chovat jinak, než buňky svalu srdce, neurony,...
K udělování výjimek máme mechanismus který umí telomeru prodloužit. Toto „oblafnutí“ biologických hodin zařizuje enzym telomeráza. Buňkám v její péči se tolik telomery netřepí a na svůj věk vypadají mladší. Není divu, že tento enzym elixíru mládí vědce zajímá. A jak tato přirozená substance věci makropulos působí? Při neošoupaných telomerách nemá buňka potřebu vyhlašovat stav nouze a aktivovat gen p53 se všemi jeho nectnostmi. S tím souvisí nová představa amerických vědců, kteří dokonce prohlásili krátké telomery za hlavního viníka našeho nevalného zdraví v pokročilém věku. Dokládají to právě vydaným článkem v časopisu Nature. Vedoucí massachusettského týmu Ronald DePinho v něm popisuje, jak se jim podařilo zvýšením hladiny enzymu telomerázy zvrátit u myší příznaky stárnutí. Článek vrhá na telomery nové světlo. Jejich špatný stav spouští celou řadu reakcí vedoucích ke zhoršování zdraví a je na úkor dlouhověkosti. Markantní je to například u buněk svalu, které ve stáří trpí poklesem počtu mitochondrií. Jejich výpadkem se buňkám tvoří málo energie (ATP), ztrácíme vitalitu, selhávají i buňky srdečního svalu. S nedostatkem energie roste riziko dalších metabolických poruch, jako je například diabetes. To všechno má podle Američanů společného jmenovatele. Házet do jednoho pytle tak nesourodé mechanismy, jako jsou chromozomy buněčného jádra a mitochondrie, které mají vlastní DNA a jsou samostatnými elementy v cytoplazmě, je ale hodně silná káva.
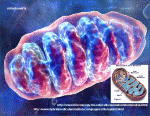
Telomery a funkce mitochondrií
To, že špatná funkce telomer vede k metabolickým poruchám a selhávání orgánů není novinkou. Novým poznatkem je zjištění, jak se to děje a že v tom účinkuje gen p53. Jeho aktivaci spouští krátká telomera. Jakmile tento gen vzbudí, potlačí funkci dvou hlavních regulátorů metabolismu mitochondrií - PGC1-alfa a PGC1-beta. A tady se dostáváme k oné dříve netušené souvislosti. Gen p53 má tak dlouhé prsty, že dosáhne až na mitochondrie a přidusí jejich metabolické procesy. On je tedy tím zloduchem, který buňky připraví o dostatek energie, což následně způsobí problémy v řadě orgánů. Náročné procesy s velkou spotřebou ATP v buňkách se hroutí. Pomocí pokusů na myších si vědci ověřili, že vyřazení genu p53 (jeho cíleným poničením genovým knokautem), odbrzdí PGC1-alfa a beta, čímž vzroste metabolismus mitochondrií a také glukoneogenese v játrech. Jde o první studii, která dává dohromady „hrušky s jablky“ - dva nesourodé systémy - jeden v jádře a druhý v cytoplazmě s vlastní DNA.

Závěr
Podle vědců z Harvardu není třeba za vším hledat ženu. Za hlavní problémy v našem stáří prý může aktivace genu p53. Autoři článku jsou plni optimismu a prognózují pomocí enzymu telomerázy nové způsoby terapie. Například při nápravě předčasného a rychlého stárnutí. Na to, zda se jim bude dařit z nás v požehnaném věku dělat křepčící stařečky a stařenky, panují různé názory. Asi to bude složitější, než jak se to nyní jeví. Především proto, že laškování s genem p53 má i druhou stránku mince. Myši, které jiný tým genetiků upravil tak aby měly tento gen líný, měly problémy s buňkami, kterým se říká kmenové. Tyto buňky má tělo v zásobě, aby mohlo průběžně nahrazovat ty opotřebované. Zmíněné myši si ale zásoby těchto buněk vyčerpaly předčasně. Pokud by si tedy někdo vzal do hlavy, že z nás za pomoci telomerázy udělá kmety podobné těm z doby biblické, musí počítat s tím, že gen p53 bude rozhodně proti.
Pramen: Harvard University, Nature: doi:10.1038/nature09787
Výročí nejstaršího člověka v dějinách
Autor: Vladimír Socha (25.10.2017)
Klotho by nás mohla zachovat fit a mysli otevřené
Autor: Josef Pazdera (12.08.2017)
Zklamání z resveratrolu
Autor: Josef Pazdera (22.05.2014)
Výdobytky modernej medicíny a dôchodcovia na krku ekonomiky
Autor: Matej Čiernik (06.04.2014)
Pozměňování metylomu nabízí nové možnosti
Autor: Josef Pazdera (26.11.2012)
Diskuze:



