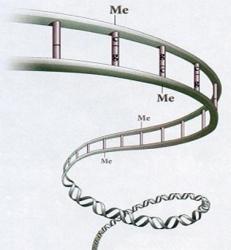
Me = metylová skupina. Umístění takové „značky“ má většinou za následek utlumení činnosti příslušného genu.
Ital Giuseppe Testa se svým milánským týmem spolupracovníků se věnoval dvojici genů jež při diferenciaci embryonálních kmenových buněk jsou aktivovány, nebo uspávány. Zjistili, že probouzení zmíněných genů dává buňkám identitu kmenových nebo nervových buněk. Hlavní roli přitom hraje protein Jumonjd3.
Učeně řečeno jde o epigenetický modulátor v procesu diferenciace embryonálních buněk, jejich přeměny v neurony. Podle vědců má ale také současně jít o krok v pochopení procesu, kterým se buňky reprogramují a tedy i poznatek směřující k novému způsobu léčby nádorů.
Epigenetické modifikace a buněčná identita
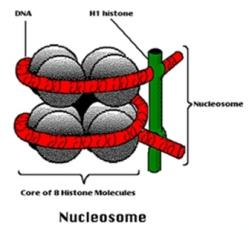
Všechny buňky našeho těla sdílejí stejnou sadu genů. Těchto genů je zhruba třicet tisíc. Naše buňky si je všechny nesou od první chvíle. Respektive od první buňky, která nám dala život a jež vznikla oplozením vajíčka. Tam to všechno začalo. Zpočátku se nám buňky jen množily, ale později se začaly diferencovat. Dostávaly identitu nervové, jaterní, svalové, chrupavkové a dalších buněk. Proces specializace buněk můžeme nazvat probouzením určitých genů k životu a jiných uspáváním. Tento selektivní proces řízené aktivity genů má co do činění s procesem, kterému říkáme epigenetika. Jde o řízení exprese genů (vyjádření, neboli jejich projevu) bez ohledu na jejich DNA sekvenci. V procesu probouzení a uspávání genů nejde o žádnou změnu pořadí nukleotidů ve stavbě genů. Epigenetické řízení aktivity genů je založeno na metylaci histonů. Histony jsou skupina malých proteinů, které se podílí na výstavbě chromatinu v jádře buněk. Podílejí se na uspořádání DNA chromozomu do vláken vyššího řádu.
Histony formují proteinové jádro nukleosomy. To jsou opakující se jednotky v chromatinu, podél nichž je DNA ovinutá a zhutněná. To aby zabírala v buňce co možná nejmenší prostor. Jako ostatní proteiny, tak i histony jsou tvořeny z aminokyselin uspořádaných do lineárního řetězce. Jeden z konců tohoto řetězce vyčnívá z nukleozómu jako ocásek a je přístupný k epigenetickým hrátkám. Specifické proteinové komplexy řídí metylaci těchto ocáskových výčnělků během buněčné diferenciace. To způsobuje přestavbu chromatinu. Z pohledu funkčnosti tento proces znamená lepší, či horší zpřístupnění určitých úseků na chromozomu a tím snadnější či horší čtení tamního genetického zápisu. Jinak řečeno - jde o a aktivaci nebo utlumení specifických genů. Jakési doladění genů z hlediska jejich výkonnosti, což mluvou automobilistů jde nazvat mírou sešlápnutí pedálu a určením „na jaké pecky ten který gen pojede“.
Co se našeho objevu týče, jde o poznatek týkající se metylace dvou aminokyselin v histonu H3. Konkrétně jde o pozice lyzinu 4 a lyzinu 27. Jejich metylace má protikladný efekt na genovou expresi u kmenových buněk. Je-li metylován lyzin 4, gen je probuzen (vyjádřen a exprimován). Je-li metylován lyzin v pozici 27, gen je uspán.
Selhání tohoto metylačního nástroje změní identitu buněk. Bylo by nošením dříví do lesa rozvádět, že selhání vede k patologickým stavům u embryí i dospělých a že řada takových případů končí rakovinou. Za zmínku stojí, že jde o poruchy, jež patří k největším zabijákům. Poruchy této metylace lyzinu ve zmiňovaných pozicích (nesprávném uspávání genů metylací histonu H3 v pozici lyzinu 27) souvisí s rakovinu tlustého střeva, prsu a prostaty. Nenormální epigenetické modifikaci se někdy říká také epimutace.
Celá desetiletí byla metylace histonů pokládána za nevratný chemický proces. Není to dlouho, co byl objeven proces demetylace (odstraňování metylových skupin z genů). K tomuto procesu dochází za určitých podmínek samovolně. Například při buněčné diferenciaci. Jde o povzbudivý poznatek, neboť jde-li demetylovat chybně metylované části genomu, měly by se časem najít i cesty nápravy a cesty k nápravě v šíření rakovinně zvrhlých buněk naším tělem.
Jumonjd3 a dynamická identita nervových buněk
Jumonjd3 je vlastně enzym, který řídí diferenciaci kmenových buněk směrem k neuronům. Kmenové buňky posouvá v jejich vývoji tím, že odstraní uspávací signály z genů, jež jsou pro nervové buňky důležité.
V embryonálních kmenových buňkách je v tomto směru nejdůležitější skupina genů označených jako bivalentní. Jsou charakterizovány stavem jejich histonu H3. Jde o metylace ocásků – lyzinu 4 a lyzinu 27. Jejich metylace má antagonistický vliv. Během vývoje v nervovou buňku ztrácejí zmíněné geny (demetylací jednoho z lyzinových zbytků) svůj bivalentní charakter. Vede to k celkovému probuzení nebo celkovému útlumu genů, jež určují kmenové buňce novou (neuronální) identitu.
Enzym, který o tom rozhoduje je onen zmíněný protein příšerného názvu „Jumonjd3“. V rámci objektivity nutno podotknout, že Japoncům se toto označení tak příšerné nezdá. V japonštině to znamená „křížový“. Objev tohoto křížového enzymu odhalil epigenetické modifikace regulující dynamické řízení aktivity genů. Pod těmito učenými formulacemi je nutno spatřovat osud buněk. Vědci soudí, že protein Jumonjd3 se jednoho dne stane důležitým prvkem při léčebném programování a přeprogramování buněk a tím i jejich funkcí. Objev by měl přispět k nalezení nových terapií nenormálního buněčného vývoje a k zamezení rakovinového bujení. Zatím presentované výsledky se týkaly výsledků italského pracoviště. Podobným směrem se ale ubírá i výzkum v ČR. Také v našem Biofyzikálním ústavu vědci zavětřili, že sledování modifikace histonu H3 je krok správným směrem a rozjeli tímto směrem své aktivity. Náš výzkum je zaměřen na stav histonu H3 v granulocytech. Předpokládá se, že by výsledky mohly sloužit jako prognostický marker stavu a účinnosti léčby u pacientů s chronickou myeloidní leukémií. Při troše štěstí by se mohly najít inhibitory patogenních klonů lymfocytů, které by zabránily recidivám leukémie. Do našich výzkumných vod se vrátíme až po ukončení projektu. K tomu má dojít v prosinci příštího roku.
Pramen: IFOM - The FIRC Institute of Molecular Oncology Foundation
Po vypnutí jednoho genu se můžete přecpávat dle libosti
Autor: Stanislav Mihulka (09.12.2018)
Tatínkovy vzpomínky zapsané do spermií
Autor: Josef Pazdera (12.11.2018)
Bimaternální dcery žijí déle než jejich vrstevnice
Autor: Josef Pazdera (14.10.2018)
Páchají stresovaní otcové na potomstvu zlo v podobě poškozených mozků?
Autor: Josef Pazdera (19.02.2018)
Jak rozluštit zakódované embryo červeným vínem
Autor: Jan Nevoral (06.11.2017)
Diskuze: